摘要:文章研发了一种新型的抗菌甲基丙烯酰硫酸软骨素微球(CSMAs),用于促进感染性创面的修复。制备的CSMAs具有优异的抗菌性、良好的生物相容性和药物缓释性能。动物实验表明,CSMAs能显著促进创面愈合。该研究结果为CSMAs在创面修复领域的应用提供了有力支撑。
关键词:微流控,水凝胶微球,细菌,感染,创面
创面修复是医疗卫生领域的难题,而水凝胶微球是一种有前景的治疗方式。但大多数微球由人工聚合物制成,很难开展临床试验及大规模使用。同时,微球直径不均匀也会导致差异性修复[1]。
本文制备了一种基于微流控电喷技术的光固化甲基丙烯酰基硫酸软骨素微球(Chondroitin sulfate methacryloyl microspheres,CSMAs)。相较于人工合成聚合物,天然来源的硫酸软骨素生物安全性更佳[2]。微流控装置可实现对液滴的精细操控,生产大小和结构均匀的微球。鉴于此,本文将具有抗菌能力的银纳米颗粒与CSMAs结合,以避免抗生素应用带来的副作用,同时建立基于CSMAs的依那西普递送系统,用以缓解炎症。
1材料
甲基丙烯酰化硫酸软骨素、银纳米颗粒(AgNPs)、荧光标记的牛血清蛋白(FITC-BSA),均购自阿拉丁试剂(上海)有限公司;L929细胞、金黄色葡萄球菌(ATCC 29213)、大肠杆菌(ATCC 25922),均购自中国科学院细胞库;依那西普,购自上海麦克林生化科技股份有限公司。
2方法
2.1微球的制备
将甲基丙烯酸化硫酸软骨素溶于PBS溶液。把此溶液抽入注射器,固定于微流控电喷装置。以3 mL/h的流速泵出溶液,针尖距接收器7 cm,静电势压9 kV。收集泵出的液滴,用365 nm、9 W/cm2的紫外光照射30 s,制成微球。
使用上述方法制备含有AgNPs的CSMAs,并根据负载AgNPs的质量浓度实施标记,如将10μg/mL AgNPs标记为CSMAs(10)。负载药物时,将冻干CSMAs加入药物溶液中,孵育2 h。
2.2微球的表征
在体式显微镜下观察水凝胶微球的形貌,利用场发射扫描电镜观察微观结构。
2.3生物相容性检测
将L929细胞以2×105密度接种于培养皿中。设置CSMAs组和对照组。用钙黄绿素和4',6-二脒基-2-苯基吲哚染色细胞,然后在荧光显微镜下观察。共培养72 h后,观察细胞增殖情况,并用CCK-8试剂盒检测细胞活性。
2.4抗菌实验
将分别负载不同质量浓度AgNPs的CSMAs置入含有0.5麦氏浊度的细菌悬液中进行共培养。于37℃培养箱中共培养24 h后,取细菌悬液进行活/死染色,并在荧光显微镜下观察。将菌液涂布于琼脂板上再孵育24 h,观察菌落生成情况。
2.5药物缓释实验
将不同质量浓度(1%、2.5%、5%)甲基丙烯酸化硫酸软骨素溶液制备的微球置于FITC-BSA(1 mg/mL)溶液中孵育。在激光共聚焦显微镜下观察凝胶微球内部的药物搭载情况。在室温下透析7 d,并用紫外-可见分光光度计检测,绘制药物释放曲线。
2.6动物实验
所有大鼠经腹腔注射氯胺酮(50 mg/kg)和羟嗪(5 mg/kg)麻醉。在大鼠背部造成直径约1 cm的圆形全层皮肤缺损,创面注射50μL麦氏浊度0.5的金黄色葡萄球菌悬液。术后将大鼠随机分为4组,分别为对照组、CSMAs(100)组、依那西普——Eta组,以及搭载依那西普的CSMAs(100)——CSMAs(100) Eta组。所有大鼠接受7 d治疗后,取创面组织进行病理学检测。
3结果与分析
3.1微球的制备
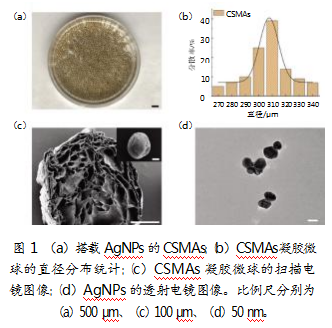
如图1a所示,采用微流控电喷技术可快速大量制备负载AgNPs的CSMAs。该微球直径均匀,呈现正态曲线分布,平均直径约为300μm(见图1b)。通过扫描电镜,发现凝胶微球内部有大量微米级孔洞,可有效搭载纳米尺寸的AgNPs(见图1c、1d)。
3.2微球的抗菌性
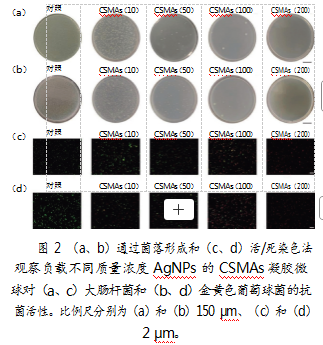
随着负载AgNPs质量浓度的增加,CSMAs的抗菌效果逐渐增强,表现为菌落数量逐渐减少(见图2a、2b)。通过细菌活/死染色也可观察到相近结果(见图2c、2d)。尤其是在CSMAs(100)组和CSMAs(200)组中,其抗菌效果显著,表明通过调节负载AgNPs的质量浓度可达到理想的抗菌效果。
3.3微球的生物相容性
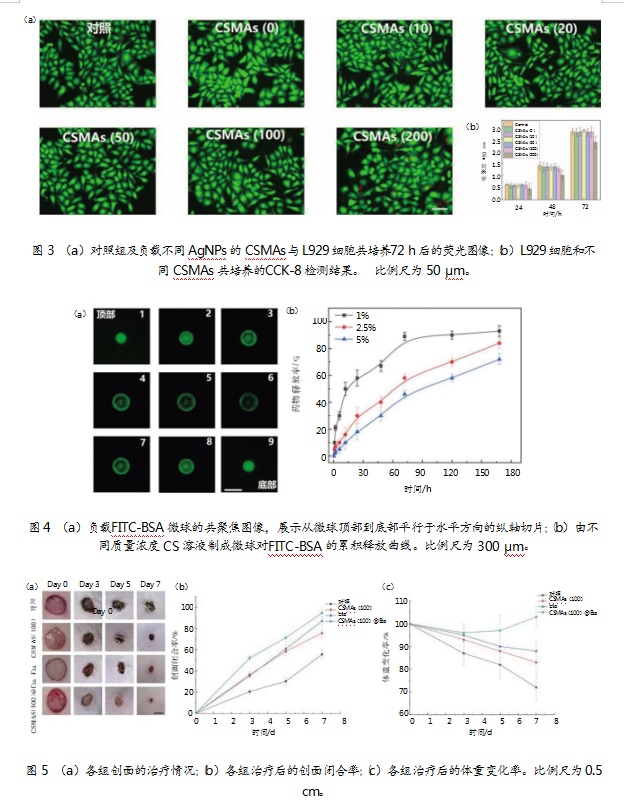
结果表明,当AgNPs质量浓度为200μg/mL时,CSMAs细胞毒性明显;当AgNPs质量浓度≤100μg/mL时,CSMAs的细胞毒性与培养基相近(见图3a、3b)。
3.4微球的药物缓释性
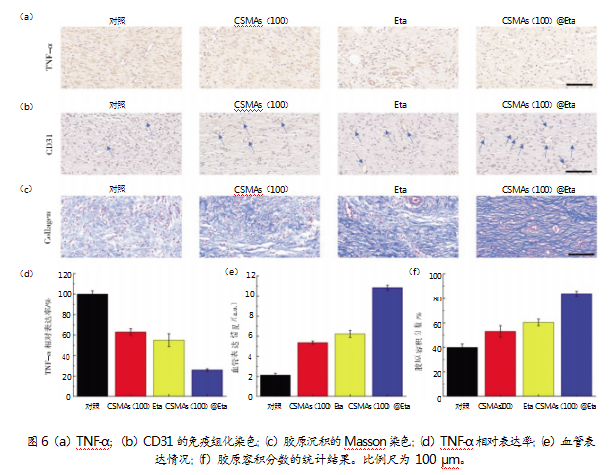
CSMAs凝胶微球的多孔结构还可搭载药物,并在局部缓释药物。如图4a所示,CSMAs可有效搭载模型蛋白药物。此外,CSMAs的药物释放率与制备凝胶微球的原料质量浓度有关。原料质量浓度越高,药物缓释时间越长。具体如图4b所示。
3.5微球的体内应用
本文在动物实验中验证了CSMAs对细菌感染创面的修复效果。结果发现,CSMAs(100) Eta组治疗创面的效果最佳(见图5a、5b)。经CSMAs(100) Eta治疗后,动物的全身状况也最好(见图5c)。
4结语
本文利用微流控电喷平台开发出了一种AgNPs和药物负载的CSMAs微球。研究发现,CSMAs具有良好的抗菌性、生物相容性与药物缓释功能,可促进感染创面的修复。
病理检测发现,经CSMAs(100) Eta治疗后,创面TNF-α的阳性结果最少、CD31的阳性结果最多、胶原容积分数最高(见图6)。
参考文献
[1]张翠娜,郑东华.基于微流控技术的光敏水凝胶微球的制备及应用[J].中国教育技术装备,2024(2):112-115.
[2]张茜,王畅,梁琛,等.硫酸软骨素应用于骨修复材料中的研究进展[J].口腔医学,2023,43(1):88-91.
文章出自SCI论文网转载请注明出处:https://www.lunwensci.com/ligonglunwen/81703.html