摘要:解离素金属蛋白酶10(ADAM10)作为一种具有蛋白水解活性的跨膜蛋白酶,与多种疾病和生理过程相关。在阿尔茨海默氏病(AD)中,ADAM10通过减少Aβ的生成、影响突触功能和维护正常神经元的功能可减轻其病理损伤。此外,ADAM10在其他脑部疾病、炎症反应、癌症以及多种生理过程中发挥着重要的作用。对ADAM10进行调控,可能有助于开发新的治疗干预药物和措施。鉴于此,文章就ADAM10与疾病的关系展开综述。
关键词:ADAM10,AD,FXS,炎症反应,癌症,生理过程
迄今为止,研究人员已鉴定出了人类解离素金属蛋白酶(ADAM)家族中的22名成员。其中,一半成员具有蛋白水解活性,且ADAM10是研究最广泛的成员之一。现有研究已鉴定出了将近100种ADAM10的底物(大多数是I型或Ⅱ型跨膜蛋白),包括黏附分子(如钙黏着蛋白)、趋化因子(例如CX3CL1)、生长因子(如EGF和肿瘤坏死因子-α)、信号受体或配体(如Notch受体和Fas配体)和淀粉样β蛋白前体(AβPP),并将ADAM10与许多重要的生物过程,如细胞黏附、细胞迁移、细胞增殖、炎症、免疫反应、胚胎发生和神经保护等联系在一起。
人体的ADAM10基因位于15号染色体(15q21-q23)上,包含16个外显子,是编码748个氨基酸的I型跨膜蛋白[1]。对于ADAM10,可以从转录水平到翻译水平和翻译后水平进行差异调节。任何不合理的表达都极有可能引发多种病理学问题。例如,ADAM10上调可能会导致癌症(异常增殖)和慢性炎症(释放过量的促炎性细胞因子);下调则可能导致某些脑部疾病(由于失去了sAPP依赖性神经保护性)。全面了解ADAM10如何上调和下调无疑有助于制订精准的、适合某类疾病的治疗策略。本文针对ADAM10与疾病的关系进行综述,以期为该蛋白的致病机理研究、疾病的临床预防及治疗提供参考。
1 ADAM10与疾病的关系
1.1 ADAM10与阿尔茨海默氏病(AD)
AD作为一种常见的神经退行性疾病,已有许多研究试图阐明其生物学基础[2]。AD的基本神经病理学改变包括β-淀粉样蛋白(Aβ)在老年斑中的细胞外积累以及高磷酸化tau蛋白组成的神经原纤维缠结(NFT)的细胞内沉积。与患者大脑中这些病变相关的一些形态和功能变化包括神经元和突触改变、星形胶质细胞增生和小胶质细胞活化等。Hardy于1992年提出的淀粉样蛋白级联假说,是接受度最广泛的假说。其凸显了Aβ在AD发病机理中的核心作用[3]。除了四个已建立的AD基因(APP、Presenilin-1、Presenilin-2和载脂蛋白E),已有研究表明ADAM10是极有可能的AD易感基因。
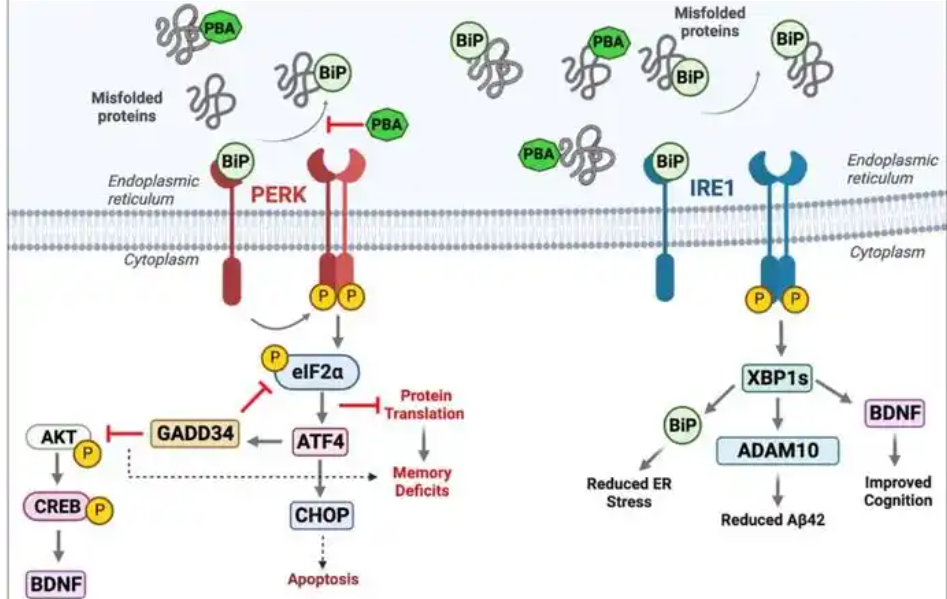
ADAM10已被确定为淀粉样β蛋白前体(AβPP)裂解过程中的组成性α分泌酶,并负责以非淀粉样的生成方式裂解AβPP,在减少Aβ生成方面起着关键作用。全基因组关联分析也表明ADAM10与AD相关[4]。已有研究通过使用截短的sADAM10发挥酶活性脱落APP来治疗AD,并释放出了多于内源水平的sAPPα[5]。
有研究称,Cas9通过激活剂纳米复合物可有效激活ADAM10,进而改善AD小鼠与Aβ沉积相关的认知缺陷,是AD治疗中有希望的治疗靶点之一[6]。ADAM10的活性在转录、翻译和翻译后水平方面,均会受到严格调控。有研究发现,跑步可上调ADAM10启动子区含有的过氧化物酶体增殖物激活受体α(PPARα)反应元件,并通过APP非淀粉样蛋白琢-分泌酶途径减少内源性Aβ的产生[7]。血小板中的ADAM10减少可能会增加AD的发生风险,而将认知测试(如MMSE)与血液生物标志物相关联可能有助于更准确地诊断AD。因此,已有研究提出,增加ADAM10活性是治疗AD的有吸引力的靶标[8]。但是,ADAM10可脱落90多种神经元底物,需仔细评估轻度ADAM10激活的副作用。
1.2 ADAM10与其他疾病
脆性X综合征(FXS)是遗传性智力残疾的最常见形式。ADAM10活性异常由遗传性突变或脆性X智力低下蛋白(FMRP)缺失导致,表现为该蛋白失去了控制ADAM10(以及AβPP)翻译的能力。这会导致sAPP琢过度生产,且mGluR5/MAPK途径被过度激活。过度的蛋白质合成以及树突棘数量和形态的变化将最终导致儿童智力障碍。在FXS中,可以通过减少ADAM10突触的定位来逆转。与AD相反,抑制ADAM10介导的APP加工对于健康脊柱的形成和功能至关重要。
作为一种生物学上的多功能蛋白酶,ADAM10在炎症反应中发挥着重要作用,主要通过释放黏附分子、趋化因子、生长因子、细胞因子等多种介质进入血液,激活炎症信号通路并参与慢性炎症反应的调控,与2型糖尿病、动脉粥样硬化等疾病的发生发展密切相关。通过条件基因敲除或发挥药理学抑制作用,靶向ADAM10可以减轻并改善动物模型中的炎症反应。
研究表明,ADAM10在多种癌症的细胞迁移和转移过程中起着潜在作用。ADAM10的过度表达可能会在口腔鳞状细胞癌、肝细胞癌、原发性葡萄膜黑色素瘤癌变和肿瘤细胞增殖过程中发挥作用[9]。在下咽鳞状细胞癌、人食管鳞癌中,ADAM10的高表达被认为可以增强对上皮-间质转化的调控,并促进肿瘤细胞的迁移和浸润。
2 ADAM10参与的生理过程
ADAM10是一种跨膜蛋白酶,主要参与各种膜结合分子的功能调节,在长骨的纵向生长和骨骼发育中起着重要的作用。ADAM10可控制干细胞生态位内的关键信号转导事件,调节肠道干细胞的稳态与更新。ADAM10在小鼠的生长发育过程中起着重要的作用。有研究表明,缺乏该基因的动物在胚胎时期就表现出了多种缺陷,尤其是在心脏、中枢神经系统、免疫系统、心血管系统、表皮、肠和血管内皮中,并且胚胎会在生成的第9~10天时死亡。小鼠条件性ADAM10敲除实验表明,ADAM10在免疫,特别是在B细胞发育中发挥着关键作用。
3讨论
自纯化以来,有关ADAM10的研究就开始呈指数级增长,这是因为其首先引起了AD的中心作用。尽管激活对AD患者可能有好处,但在其他情况下,包括癌症、肿瘤进展、转移、FXS、炎症等,可能是非常有害的。从长远角度来看,有必要开发针对组织基质特异性ADAM10的药物,以减少不必要的全身效应。此外,大多数研究均使用体外方法来识别ADAM10的底物。因此,除了迫切需要在体内确认这些候选者,还需要注意毒性作用可能会限制ADAM10激活的新底物。
研究发现,ADAM10是有希望治疗多种疾病的靶标。但是,由于ADAM10对健康和疾病的影响,在疾病治疗中靶向底物特异性ADAM10可能是避免毒副作用的必要条件。
参考文献
[1]WENCEL L P,BLECHARZ-KLIN K,PIECHAL A,et al.Fingolimod modulates the gene expression of proteins engaged in inflammation and Amyloid-Beta metabolism and improves exploratory and Anxiety-Like behavior in ObeseMice[J].Neurotherapeutics:the JournaloftheAmerican Society for Experimental Neuro Therapeutics,2023,20(5):1388-1404.
[2]REN R J,QI J L,LIN S H,et al.The China alzheimer report 2022[J].General Psychiatry,2022,35(1):e100751.
[3]MARIONI R E,HARRIS S E,ZHANG Q,et al.Correction:GWAS on family history of Alzheimer's disease[J].Translational Psychiatry,2019,9(1):161.
[4]STEFANO M,SEBASTIENT,SILVIA P,et al.The development of ADAM10 endocytosis inhibitors for the treatment of Alzheimer's disease[J].Molecular therapy:the Journal of the American Society of Gene Therapy,2022,30(7):2474-2490.
[5]SARAH A H,SIVAN G,RAWAD H,et al.Shifting the balance:soluble ADAM10 as a potential treatment for Alzheimer's disease[J].Frontiers in Aging Neuroscience,2023,151:171123.
[6]HANSEUL P,YERIM H,JONGPIL K.Transcriptional activation with Cas9 activator nanocomplexes rescues Alzheimer's disease pathology[J].Biomaterials,2021,279:121229.
[7]B S R,MALABENDU J,SRIDEVI D,et al.Treadmill workout activates PPARαin the hippocampus to upregulate ADAM10,decrease plaques and improve cognitive functions in 5XFAD mouse model of Alzheimer's disease[J].Brain,Behavior,and Immunity,2023,109:204-218.
[8]KARIKARI TK,ASHTON NJ,BRINKMALM G,et al.Blood phospho tau in Alzheimer disease:analysis,interpretation,and clinical utility[J].Nature Reviews Neurology,2022,18(7):400-418.
[9]Shiu JS,Hsieh MJ,Chiou HL,et al.Impact of ADAM10 gene polymorphisms on hepatocellular carcinoma development and clinical characteristics[J].International Journal of Medical Sciences,2018,15(12):1334-1340.
文章出自SCI论文网转载请注明出处:https://www.lunwensci.com/ligonglunwen/81275.html