SCI论文(www.lunwensci.com):
摘要:异丙醇-环己烷双液系相图是大学物理化学实验中关于相平衡知识运用的一个实验项目。本文对实验过程中几个值得推敲的问题从理论上进行深度分析。解析清楚后,更便于学生深刻理解实验原理,明白哪些具体操作会带来实验误差,哪些操作即便不准确也不会造成实验结果有偏差。结果表明:在具体形状的圆底烧瓶里加热异丙醇和环己烷两组分系统,能得到固定沸点;加工圆底烧瓶时应在保证能取液分析的前提下尽可能小,以免小槽内液体的组成与待测气相组成偏差过大;固定外压下,恒沸点及恒沸组成固定;每次为了改变系统组成加入一定量的异丙醇时,实际移取液体体积与设定体积若有偏差,对绘制相图并无影响。
关键词:物理化学;双液系相图;误差分析
0引言
《物理化学》课程是大学理工科、医科许多专业很重要的一门专业基础课,《物理化学实验》课程是理论与实践的结合,是理论在实践中的应用和体现[1]。异丙醇-环己烷双液系相图的绘制又是物理化学实验课中很重要的一个实验项目,其中涉及到仪器的组装、实验的构思、原理的应用、数据的测量和误差的分析等能力的训练。如果实验过程仅流于形式,老师讲,学生一知半解、照猫画虎地做,对很多环节和数据吃不透,那么一次实验只能是肤浅地完成教学任务,学生分析问题的能力就没有得到提升,学习也只是停留在对理论结果机械记忆的层面。为此,作者就该实验中几个值得思考的问题从理论上进行解析,希望能对读者深度理解和把握该实验的每个环节有所帮助。
1实验原理
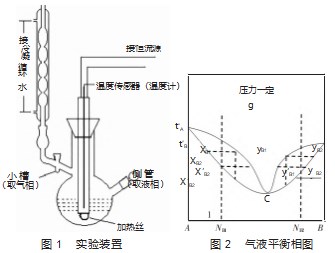
异丙醇与环己烷混合,属于二组分真实液态完全互溶系统,测量相图的实验装置见图1。实验中要完成的目标是在恒定实验室的大气压下,绘制二者气-液两相平衡的温度-组成图,归属于图2描绘的类型,温度-组成图中会出现最低点即最低恒沸点C,说明二者是具有最大正偏差的系统[2-3]。
2探讨和误差分析
2.1关于两相平衡时沸点的分析
合液,当温度恒定后,记下沸腾温度,便是两相沸点,说明加热过程中一定会出现一个固定的沸点。但是用相律分析就不是这样的结果,C=S-R-R'=2,压力一定下,自由度数F=C-P+1=1,说明两相平衡温度t、平衡时液相组成xB和气相组成yB,3个变量中只有1个量可以自由变化,也就是说加热一定系统组成NB的混合液,直到两相共存时,相平衡温度t是会继续上升的,并不会出现恒定温度。实验要求和理论推理出现了矛盾,但确实在实验中出现了恒定沸点,究其原因可能是因为,如果容器足够密封的情况下,每一个具体的圆底烧瓶,结构、形状固定,当加热一定时间后,容器内气、液两相的量nl、ng因达到了动态平衡,就不再发生变化,按照杠杆规则,气相组成yB、液相组成xB分别也就固定了,再依据相律可知两相平衡的温度(即沸点t)也就有了定值,因此会出现实验中加热到一定时间,温度不变的现象。
另外,需要说明的是,由于玻璃仪器加工的差异,每一组同学拿到的具体圆底烧瓶形状有差异,平衡时气液两相的量就会有差异。因此,即便在各自都加入同一个系统组成NB的液体混合物时,测量的沸点t和两相组成xB、yB也会有差异。但是,即便因此产生差异,也不会造成对最终绘制的相图有误差,因为,都是不同系统组成对应的相点,而这些点都在相图上,只是略微左移或者右移的问题[4]。
2.2关于测量气相组成yB的分析
绘制相图还需要测量两相平衡时液相组成xB及气相组成yB,液相组成xB就从图1中标注的取液相的侧管取液,用折光仪测量折光率,查标准曲线得到液相组成xB[5]。但是气相是无法通过折光仪得到折射率的,图1中左上方的回流管会将挥发的气体冷凝成液体,储存在取气相的小槽里,所以从小槽中取液测折光率,查标准曲线得到的就是气相组成yB。可事实上,单纯说组成为yB的气相液化后,形成的新的气液两相平衡系统,两相组成用x′B、y′B表示,根据相图可知,真实的气相组成yB不等于小槽里液体的组成x′B。
需要分两种情况讨论,一种是系统组成(如NB1)在C点左侧,系统组成小于恒沸组成,NB1<CB,根据相图,平衡时气相组成yB1<CB,当yB1的气相液化后,小槽内的液体组成x′B1与其平衡的气相组成y′B1的关系为x′B1<y′B1;二是系统组成(如NB2)在C点右侧,系统组成大于恒沸组成,NB2>CB,则相应有yB2>CB,x′B2>y′B2。也就是说,无论哪一种情况,真实的气相组成yB都不等于小槽里液体的组成x′B,也就是说,移取小槽内的液体测折光率对应的组成与真实气相组成yB或大或小都是有偏差的。但是,实验中所用冷凝管的内管很细,足够的冷凝水能完全将管内少量的气体全部液化储存在小槽里,小槽里液体非常少,根据相图可知,只有完全液化的液体组成才会和气体组成相等,这种情况下yB就会近似等于x′B。冷凝管越细,小槽越小,因此产生的误差就越小。所以在加工玻璃仪器时,应在能保证冷凝的前提下,冷凝管内管要细;应在保证能够取液测量的前提下,小槽尽量要小。
2.3关于恒沸点自由度数的分析
异丙醇-环己烷体系的温度组成图出现最低点C,是最低恒沸点,恒沸点的温度叫恒沸温度,对应的两相组成叫恒沸组成。从自由度数角度对恒沸点进行分析,恒沸点时气相线和液相线相切,气、液两相的组成存在等量关系,即xB=yB,也就是说,在恒沸点时有一个特殊的浓度关系,R′=1。因此,C=S-R-R′=1,自由度数F=C-P+1=0,即恒沸温度t,恒沸点液相组成xB、气相组成yB,在一定压力下都会有定值,但是不同压力下,这3个定值是不同的[6-7]。
2.4关于移取液体精度的分析
为了改变系统组成,实验中需要不断地加入其中一个组分。以向环己烷中加入异丙醇为例,比如要加入2 mL异丙醇,这个移取液体并不需要十分精确。因为多一点或者少一点,真实产生的系统组成与精确加入2 mL形成的系统组成虽然有偏差,但只是相当于左移或者右移了两相点,但这些相点都在相图上,并不会造成最终绘制的相图有误差。所以,移取液体不需要十分精确。
3结论
在异丙醇-环己烷双液相图绘制的实验中,经过分析论证,得到如下结论。在实验室压力下,二者一定有固定的最低恒沸点和恒沸组成,理论上每组所绘相图,恒沸点横纵坐标应该相同;为改变系统组成而加组分,移取液体时并不需要十分精准,因为不会对相图造成影响;冷凝管内管要稍微细,承载气相组分的小槽加工时要尽可能小;加热直到温度显示不变,该温度是玻璃容器形状固定下的气液两相的量对应的沸点,若改变玻璃容器的外形,同一组成,沸点就会不同,但不会对整体相图造成影响。
参考文献
[1]东北师范大学.物理化学实验[M].北京:高等教育出版社,2014.
[2]刘俊吉,周亚平,李松林,等.物理化学(下):第六版[M].北京:高等教育出版社,2017.
[3]傅献彩,沈文霞,姚天扬,等.物理化学(下):第五版[M].北京:高等教育出版社,2005.
[4]易回阳,陆江林.对异丙醇—环己烷双液系相图实验条件改进的讨论[J].湖北师范学院学报,2000,20(3):63-65
[5]赵明坚,王永尧,方文军,等.双液系气液平衡相图实验沸点仪的改进:基于化学实验教学EHS理念的考虑[J].化学教育,2019,40(10):43-46.
[6]杨喜平,物理化学的互动-探究式教学研究:以二组分理想溶液系统的气、液平衡的讲授为例[J].化学教育,2016,37(12):14-17.
[7]赵洪波,乔秀丽,马松艳.双液系气—液平衡相图实验的改进与探索[J].绥化学院学报,2019,39(2):133-135.
关注SCI论文创作发表,寻求SCI论文修改润色、SCI论文代发表等服务支撑,请锁定SCI论文网! 文章出自SCI论文网转载请注明出处:https://www.lunwensci.com/ligonglunwen/77902.html