SCI论文(www.lunwensci.com)
摘要:文章研究了饱和状态下硫酸盐之间存在的部分反应,是非饱和态下较难发现的。该反应存在一定规律,值得进一步探讨与研究。该反应可以为复合肥料的生产提供研究资料,特别是硝硫基复合肥中使用大量的硝铵磷、硫酸钾、硫酸铵、硫酸锰、硫酸镁等原料,复合肥中硫酸盐是以硫酸复盐的形式存在而非以简单化合物混合而成,会影响到复合肥产品强度与储存的稳定性。
关键词:饱和溶液;硫酸复盐;结晶水
0.引言
许多物质的非饱和溶液互相混合后,由于没有产生沉淀或气泡等现象,人们认为该两种或多种物质的溶液混合后不反应,从而失去了改变一些条件认识这些反应的新的机会。硫酸盐在同一温度下,不饱和溶液相互混合无反应现象而在饱和或接近饱和状态下溶液相互混合出现结晶沉淀的现象。通过X射线衍射仪进行分析该结晶物是含结晶水的硫酸复盐,这些含结晶水的硫酸复盐[1]在硝硫基复合肥中较为常见,对复合肥产品的强度以及溶解性能有一定的影响,值得进一步研究。下面梳理一下饱和态下硫酸复盐的反应。
1.试验部分
1.1试验设备准备
250 mL烧杯12个、100 mL烧杯24个、50 mL量筒1个、25 mL量筒1个、玻璃棒12根(长为15 mm)、吸管12支、温度1支、电热恒温烘箱等。
1.2分析纯药剂准备
硝酸铵、硫酸镁、硫酸锌、硫酸锰、硫酸亚铁、硫酸铜、硫酸铁、硫酸铝、硫酸钾、硫酸铵、硫酸钠各1瓶、去离子水1 000 mL、无水酒精500 mL等。
1.3试验准备与步骤
将1 000 mL去离子水进行加热至100℃,密封冷却存放至室温状态(25℃),以减少去离子水中的溶解氧,减少硫酸亚铁的氧化。上述12个250 mL的烧杯中加入100 mL去离子水,分别将1.2中的11种药剂搅拌配成过饱和溶液,在无尘环境中静止2~4 h,以确保溶液的饱和状态。试验时,吸取上部澄清溶液待用。
分别吸取硫酸镁、硫酸锌、硫酸锰、硫酸亚铁、硫酸铜、硫酸铁、硫酸铝饱和溶液40 mL放置在100 mL的烧杯中,同时将硝铵饱和溶液10 mL分别导入硫酸镁、硫酸锌、硫酸锰、硫酸亚铁、硫酸铜、硫酸铁、硫酸铝饱和溶液的烧杯中。溶液混合后,1~5 min内有大量的晶体析出,结晶通过过滤以及无水酒精的洗涤后,封存备用分析。考虑到研磨可能失去部分结晶水,用玻璃棒进行搅拌,避免生成大颗粒的晶体,以确保对生成物质结晶水检测的准确性。
1.4检测与分析
为准确检测出生成物质的分子的结构或形态,对硫酸锌与硝酸铵生成的物质进行了X射线衍射分析,依据JY/T 0587—2020《多晶体X射线衍射方法通则》。硫酸锌与硝酸铵生成物质X射线衍射图,如图1所示,分析结果如表1所示。
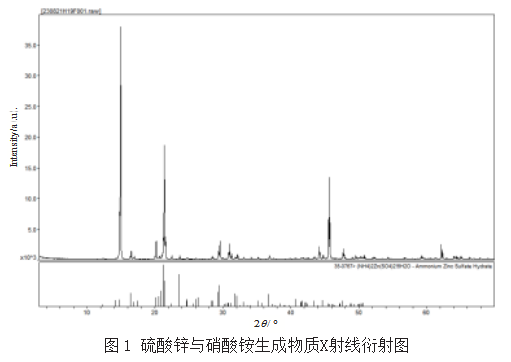

通过X射线衍射分析,饱和态下硫酸锌与硝酸铵生成物为(NH4)2Zn(SO4)2·6H2O,对上述生成物质特征有了初步认识,考虑到试验以及分析的项目较多,利用原子吸收光谱分光光度计对铜铁、锰、锌、铝、铁等金属进行了单质含量分析,依据GB/T 19203—2003《复混肥料中钙、镁、硫含量的测定》对“硫”进行含量分析;依据NY/T 2542—2014《肥料总氮含量的测定》对“氮”进行含量分析;考虑到上述物质的热稳定性,通过分段恒温加热的方式测试上述生成物的结晶水的数量,如表2所示。
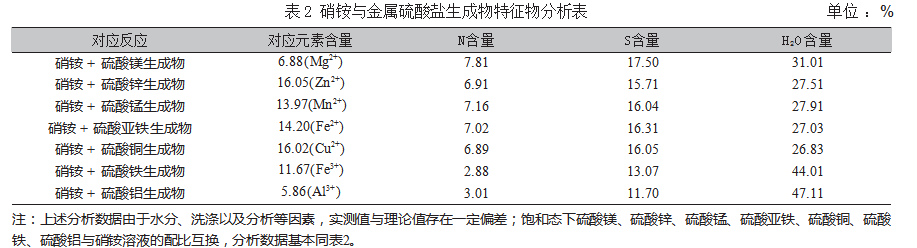
通过上述物质特征物含量的分析,分别推导出相应的生成物质分别是(NH4)2Mg(SO4)2·6H2O、(NH 4)2 Zn(SO 4)2·6H 2 O、(NH 4)2 Mn(SO 4)2·6H 2 O、(NH 4)2 Fe(SO 4)2·6 H 2 O、(NH 4)2 Cu(SO 4)2·6 H 2 O、(NH4)Fe(SO4)2·12H2O、(NH4)Al(SO4)2·12H2O。为更好呈现反应,根据上述生成物质推导其反应的化学方程式如下:
饱和状态下,硫酸镁与硝酸铵溶液混合后的反应:2MgSO4+2NH4NO3+6H2O=(NH4)2Mg(SO4)2·6H2O↓+Mg(NO3)2(1)
注:该反应迅速形成大量白色沉淀。
饱和状态下,硫酸锌与硝酸铵溶液混合后的反应:2ZnSO4+2NH4NO3+6H2O=
(NH4)2Zn(SO4)2·6H2O↓+Zn(NO3)2(2)
注:该反应迅速形成大量白色沉淀。
饱和状态下,硫酸锰与硝酸铵溶液混合后的反应[2]:
2MnSO4+2NH4NO3+6H2O=
(NH4)2Mn(SO4)2·6H2O↓+Mn(NO3)2(3)
注:该反应迅速形成大量白色沉淀。
饱和状态下,硫酸亚铁与硝酸铵溶液混合后的反应:2FeSO4+2NH4NO3+6H2O=
(NH4)2Fe(SO4)2·6H2O↓+Fe(NO3)2(4)
注:该反应迅速形成大量浅绿色沉淀。
饱和状态下,硫酸铜与硝酸铵溶液混合后的反应:2CuSO4+2NH4NO3+6H2O=
(NH4)2Cu(SO4)2·6H2O↓+Cu(NO3)2(5)
注:该反应迅速形成大量蓝色沉淀。
饱和状态下,硫酸铁与硝酸铵溶液混合后的反应:2Fe2(SO4)3+3NH4NO3+12H2O=
3(NH4)Fe(SO4)2·12H2O↓+Fe(NO3)3(6)
注:该反应迅速形成大量红棕色沉淀。
饱和状态下,硫酸铝与硝酸铵溶液混合后的反应:2Al2(SO4)3+3NH4NO3+12H2O=
3(NH4)Al(SO4)2·12H2O↓+Al(NO3)3(7)
注:该反应迅速形成大量白色沉淀。
上述反应后的溶液中仍有大量的Mg2+、Zn2+、Mn2+、Fe2+、Cu2+、Fe3+、Al3+、SO4(2)-、NH4+、NO3-离子存在,印证上述生成物溶于水,沉淀不同溶解度也各异。上述反应结晶物质按反应编号如图2所示。

2.小结与验证试验
通过上述试验生成物质特征元素的含量分析,生成物质基本确定是含结晶水的硫酸复盐:2价金属阳离子与铵根离子按摩尔比1∶2的配比进行结合,含6个结晶水;3价金属阳离子与铵根离子按摩尔比1∶1的配比进行结合,含12个结晶水,有一定的规律。通过特征物的分析,上述反应的物质是由金属硫酸盐与硫酸铵按一定的摩尔比进行组合且含有结晶水硫酸复盐。为进一步验证上述生成物质稳定存在,安排如下试验进一步验证生成物:
根据上述推理,在饱和态下的硫酸铵溶液代替硝酸铵与饱和态下的硫酸镁、硫酸锌、硫酸锰、硫酸亚铁、硫酸铜、硫酸铁、硫酸铝进行混合,进一步探索试验:
试验部分、试验设备与试剂、试验准备与步骤、检测与分析(检测方法)均同上。
硫铵与金属硫酸盐生成物特征物分析表如表3所示。
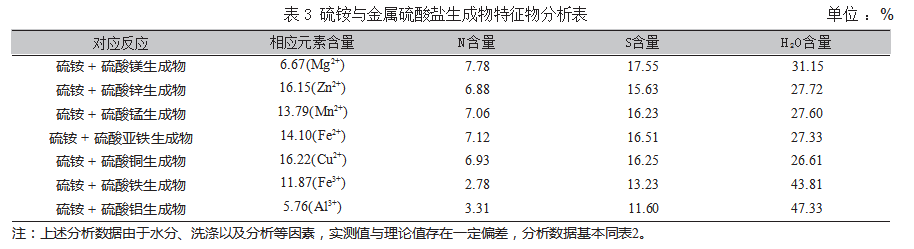
饱和态下硫酸铵与硫酸镁、硫酸锌、硫酸锰、硫酸亚铁、硫酸铜、硫酸铁、硫酸铝分别混合推导出相应的生成物质,生成物分别是:NH4)2Mg(SO4)2·6H2O、(NH 4)2 Zn(SO 4)2·6H 2 O、(NH 4)2 Mn(SO 4)2·6H 2 O、(NH 4)2 Fe(SO 4)2·6 H 2 O、(NH 4)2 Cu(SO 4)2·6 H 2 O、(NH4)Fe(SO4)2·12H2O、(NH4)Al(SO4)2·12H2O。该生成物具有一定稳定性。
通过上述生成物的分析,为呈现其反应推导其化学方程式如下:
饱和硫酸镁与饱和硫酸铵溶液的反应:
MgSO4+(NH4)2 SO4+6H2O=(NH4)2Mg(SO4)2·6H2O↓(8)
注:迅速形成大量白色沉淀。
饱和硫酸锌溶液与饱和硫酸铵溶液的反应:
ZnSO4+(NH4)2 SO4+6H2O=(NH4)2Zn(SO4)2·6H2O↓(9)
注:迅速形成大量白色沉淀。
饱和硫酸锰溶液与饱和硫酸铵溶液的反应:MnSO4+(NH4)2 SO4+6H2O=
(NH4)2Mn(SO4)2·6H2O↓(10)
注:迅速形成大量白色沉淀。
饱和硫酸亚铁溶液与饱和硫酸铵溶液的反应:FeSO4+(NH4)2 SO4+6H2O=
(NH4)2Fe(SO4)2·6H2O↓(11)
注:迅速形成大量浅绿色沉淀。
饱和硫酸铜溶液与饱和硫酸铵溶液的反应:CuSO4+(NH4)2 SO4+6H2O=
(NH4)2Cu(SO4)2·6H2O↓(12)
注:迅速形成大量蓝色沉淀。
饱和硫酸铁溶液与饱和硫酸铵溶液的反应:Fe2(SO4)3+(NH4)2 SO4+12H2O=
2(NH4)Fe(SO4)2·12H2O↓(13)
注:迅速形成大量红棕沉淀。
饱和硫酸铁溶液与饱和硫酸铵溶液的反应:
Al2(SO4)3+(NH4)2 SO4+12H2O=
2(NH4)Al(SO4)2·12H2O↓(14)
注:迅速形成大量白色沉淀。
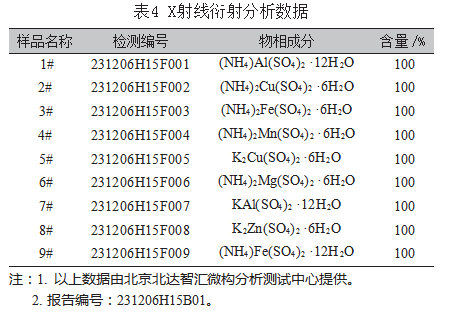
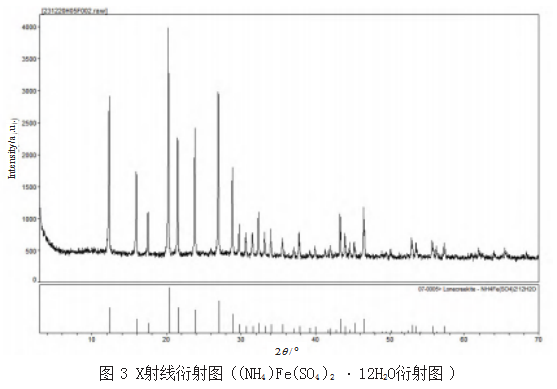
由于实测值与理论值存在一定偏差,上述生成物也是客观存在,但不能100%准确测定其分子的结构或形态,特别是结晶水的测定。严谨起见,对上述生成物进行了X射线衍射分析,分析结果如表4所示,附代表性X射线衍射图((NH4)Fe(SO4)2·12H2O)如图3所示。
3.总结与试验拓展
通过X射线衍射分析进一步确定了上述反应以及生成物的存在,进一步探索硫酸盐之间还存在哪些反应:探索1:用硫酸钠代替硫酸铵以观察存在哪些反应;探索2:用硫酸钾代替硫酸铵以观察存在哪些反应。
3.1试验准备与步骤
试验准备与步骤同上。
3.2试验结果与现象
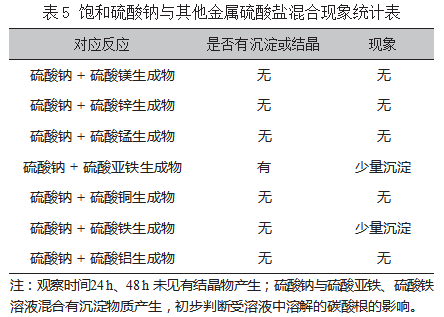
探索1:饱和态下的硫酸钠代替硫酸铵与硫酸镁、硫酸锌、硫酸锰、硫酸亚铁、硫酸铜、硫酸铁、硫酸铝的混合,具体现象如表5所示。
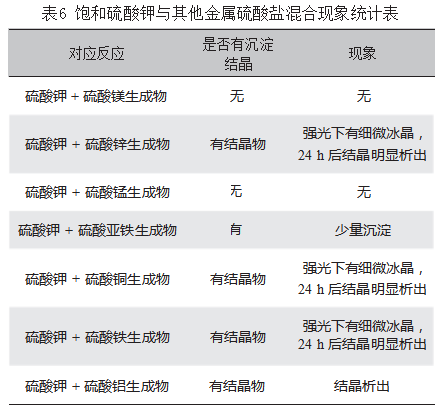
探索2:饱和态下的硫酸钾代替硫酸铵与硫酸镁、硫酸锌、硫酸锰、硫酸亚铁、硫酸铜、硫酸铁、硫酸铝的混合,具体现象如表6所示。
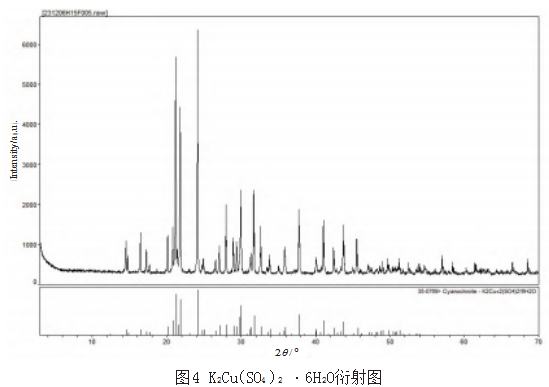
为明确上述反应物的具体形态,对反应的生成物直接进行X射线衍射分析,分析结果如表4所示。通过分析数据,饱和态下硫酸钾与硫酸锌、硫酸铜、硫酸铝分别生成了K2Zn(SO4)2·6H2O、K2Cu(SO4)2·6H2O(其衍射图如图4所示)、KAl(SO4)2·12H2O。饱和态下硫酸钾与硫酸铁虽有均匀的结晶生成物,通过2次X射线衍射分析,不能明确地确定其生成物质。
3.3反应物的分析与结果汇总
通过对上述结晶生成物质分析结果,生成物质确定是含结晶水的硫酸复盐,2价金属阳离子与钾离子按摩尔比1∶2的配比进行结合,含6个结晶水;3价金属阳离子与钾离子按摩尔比1∶1的配比进行结合,含12个结晶水,有一定的规则。钾离子与铵根离子结合的金属硫酸盐相似。上述反应的物质是由金属硫酸盐与硫酸钾按一定的摩尔比进行组合且含有结晶水硫酸复盐。生成物质的化学式为K(4-x)Rx(SO4)2·nH2O(R为2价金属离子时生成物含6个结晶水;R为3价金属离子时生成物含12个结晶水)。
对K 2 Zn(SO 4)2·6H 2 O、K 2 Cu(SO 4)2·12H 2 O、KAl(SO4)2·12H2O等物质的分析,为更清晰地呈现该反应,饱和态下硫酸锌、硫酸铜、硫酸铝和硫酸钾的溶液混合,有如下反应:
饱和状态下硫酸锌与硫酸钾的反应:
ZnSO4+K2 SO4+6H2O=K2Zn(SO4)2·6H2O↓(15)
饱和状态下硫酸铜与硫酸钾的反应:
CuSO4+K2 SO4+6H2O=K2Cu(SO4)2·6H2O↓(16)饱和状态下硫酸铝与硫酸钾的反应:
Al2(SO4)3+K2SO4+12H2O=2KAl(SO4)2·12H2O↓(17)
饱和态下除硫酸铝与硫酸钾的反应迅速,其余反应的现象:通过强光照射溶液中有少量冰晶,8~12 h后结晶明显且晶体较大。
注:结晶时间较长,存在饱和溶液的水分进一步蒸发的可能。
反应结晶图像如图5所示。

4.补充内容
(1)饱和态下氯化铵同硝酸铵、硫酸铵一样与金属2价、3价硫酸盐存在反应且混合后迅速形成沉淀;
(2)硫酸锂同硫酸钠一样与上述金属2价、3价硫酸盐不存在反应。
注:在饱和态下,特别是受控制精度以及试验室条件的影响,很容易造成溶液的过饱和,特别是混合溶液在放置过程中有水分蒸发的可能,生成物受混合摩尔比的不同,组合出含结晶水复杂的硫酸复盐。
5.总结与推测
受购买药剂的限制不能将所有金属硫酸盐进行实验,现推测如下反应:
(1)饱和硫酸铵溶液与饱和态的2价、3价金属硫酸盐混合会有反应同时生成含结晶水硫酸复盐,特殊情况很少;
(2)通过硫酸钠与文中金属硫酸盐的混合实验、饱和态下硫酸锂与文中金属硫酸盐混合不会发生反应生成含结晶水的硫酸复盐;
(3)饱和态下硫酸铷、硫酸铯等大分子量的一价金属阳离子较硫酸钾更容易与其他金属硫酸盐(饱和态)混合会发生反应并生成含结晶水的硫酸复盐;
6.应用
(1)中学课本中硝酸铵、硫酸铵、氯化铵与2价、
3价金属硫酸盐混合不发生反应,需要增加是否饱和为前置条件;
(2)制备上述硫酸复盐时,在饱和态下混合即可,不需要受摩尔比的限制;
(3)生产硝硫基复合肥,产品强度、储存性能与粉化情况可以借鉴上述反应。
参考文献:
[1]郑恩铭.硫酸盐与矾[J].化学教学,1987(3):49.
[2]宋力,胡付欣,苑仁静,等.复盐(NH4)2Mn(SO4)2·nH2O的热分析研究[J].信阳师范学院学报(自然科学版),2004,17(2):178-180.
关注SCI论文创作发表,寻求SCI论文修改润色、SCI论文代发表等服务支撑,请锁定SCI论文网!
据媒体报道,三大运营商目前均已制定了2020年... 详细>>
如何设计有效的环境治理政策, 是学术界和政策... 详细>>
