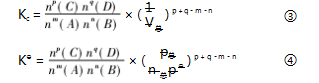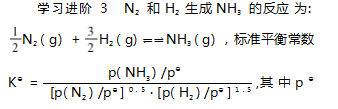SCI论文(www.lunwensci.com)
摘 要: 化学平衡常数计算是高中化学教学的重难点,教材只介绍了 Kc 的简单计算,本文基于 学习进阶的设置,梳理了 Kc 、Kp 、K⊖ 三种平衡常数的概念与计算技巧,推导出三者关于 n 的计算变 式及相互转化关系,建立“两步法”计算模型.
关键词: 化学平衡常数,两步法,高中化学
引言:人教版化学选修 1《化学反应原理》中关于化学 平衡的内容是高中化学学科内容中的核心概念之 一,也是化学教学过程中最难的主题之一.化学平衡 在宏观上是静态的,但是在微观上是动态的,它的概 念较为抽象、复杂,给学生的认识和学习造成了很大 的障碍.其中,化学平衡常数的计算更是难上加难, 近几年在高考中融入以速率、平衡为中心的原理综合 题中,使得较多学生对其望而却步,直接放弃计算.
同时,笔者发现考题中关于平衡常数的计算常有 涉及 Kc 、Kp 、K⊖ 等形式,而现行教材中却只介绍了较为 简单的浓度平衡常数 Kc 的计算,致使学生在认识上产 生盲区、在理解上产生偏差、在解题上产生恐惧.因此, 本文对常见的三种化学平衡常数进行了分类介绍,以 学习进阶的形式探究平衡常数的计算技巧,利用“两步 法”建立计算模型,帮助学生理清思路、克服计算恐惧.
2 化学平衡常数的分类
2.1 浓度平衡常数 Kc
大量实验事实表明,对一般可逆反应: mA ( g)+ nB( g) ⥫⥬pC( g) + qD( g),在一定温度下,无论 反应物的起始浓度如何,反应达到平衡状态后,生成 物浓度系数次方的乘积与反应物浓度系数次方的乘积 之 比 为 一 常 数, 即 化 学 平 衡 常 数 K =cp ( C) cq ( d)/Cm ( A) cn ( B).因该式是由平衡浓度计算所得,所以也称为浓度平衡常数,用 Kc 表示.一般而言,固体、 纯液体的浓度为定值,不列入表达式中.
2.2 压强平衡常数 Kp
在化学平衡体系中,用各气体物质的分压替代 浓度计算的平衡常数叫压强平衡常数,用 Kp 表示. 对于可逆反应: mA( g) + nB( g) ⥫⥬pC( g) + qD( g),Kp =pp ( C) pq ( d)/pm(A)pn(B)其中“某气体的分压 = 气体总压强× 该气体的体积分数( 或物质的量分数) ”,即 p( A) = p( 总) × φ( A) 或 p( A) = p( 总) ×χ( A).
2.3 标准平衡常数 K⊖
在化学平衡体系中,用各物质的相对浓度或相 对分压替代浓度计算的平衡常数叫标准平衡常数, 用 K⊖ 表示.标准平衡常数是根据标准热力学函数计算得到的平衡常数,又称热力学平衡常数,在热力 学中最为常用.根据反应体系中各物质存在形式的 不同,可将化学反应分为溶液反应、气相反应和混合 反应,对应标准平衡常数的表示方法也略有不同.
2.3.1 溶液反应中的标准平衡常数
2.3.2 气相反应中的标准平衡常数
2.3.3 混合反应中的标准平衡常数
3 化学平衡常数的计算
3.1 Kp 的计算技巧
3.1.1 直接根据分压强计算压强平衡常数
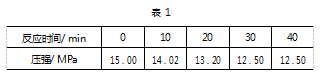
例题 用测压法在刚性密闭容器中研究 T℃ 时 4NO( g) ⥫⥬N2 ( g) + 2NO2 ( g) 的分解反应,现将一 定量的 NO 充入该密闭容器中,测得体系的总压强 随时间的变化见表 1 所示.
T℃ 时,4NO( g) ⥫⥬N2 ( g) + 2NO2 ( g) 反应的 平衡常数 Kp =_____ .
解 析 根 据 Kp 的 定 义, 可 得 Kp =p( N2 ) p2 ( NO2 )p4 ( NO).
第 一 步: 利 用 差 量 法 求 得,p ( N2 ) = Δp = 15.00MPa -12.50MPa = 2.50 MPa,则 p ( NO2 ) = 2p( N2 ) = 5. 00 MPa,p ( NO ) = 15. 00MPa -2.50MPa × 4 = 5.00 MPa.
第二步: 代入上式,求得 Kp = 0.1( MPa) -1.
3.1.2 利用变式计算压强平衡常数
学习进 阶 1 通 常 合 成 甲 醇 的 主 要 反 应 为 CO( g) + 2 H2 ( g) ⥫⥬CH3 OH( g) ,恒温( T1 ) 恒容 条 件 下,起 始 时 容 器 中 只 有 2 mol · L -1 CO 和 4 mol · L -1 H2.平衡时混合气体的压强为p1 kPa, CH3 OH 的体积分数 [φ( CH3 OH) ]与温度( T) 、压 强( p) 之间的关系如图 1 所示,则 T1 时该反应的 压强平衡常数 Kp =_____ .( 用含 p1 的代数式表示)
3.2 Kc 、K⊖ 的计算技巧
由 Kp 的计算得到提示,Kc 、K⊖ ( 气相) 也可统一 变式为关于 n 的计算式:
由此发现,Kc 、Kp 、K⊖ 的计算可简化为同一含 n 的模板,运用时仅需稍许的变动便能相互转化.该模 板将三个计算难点串联了起来,大大减轻了学生的记忆量,避免学生出现记忆混乱,且以建模的方式将 难题变成了简单题,体现了“证据推理与模型认知” 的化学核心素养.
为 标 准 压 强 ( 1 × 10 5 Pa ) ,p ( NH3 ) 、p ( N2 ) 和 p( H2 ) 为各组分的平衡分压.N2 和 H2 起 始 物 质 的量之比为 1 ∶ 3.在恒定温度和标准压强下进行 反应,NH3 的平衡产率为 ω,则 K⊖ = ( 用含 ω 的最简式表示).
解析 第一步 : 设 N2 和 H2 起始物质的量分 别为 n、3n,求得平衡时 N2 、H2 、NH3 的物质的量 分 别 为 ( 1 -ω) n、3 ( 1 - ω) n、2 ωn,n总 = ( 4 - 2 ω) n,p总 = p ⊖.
平衡常数的计算是高中化学教学的重难点,考 察角度灵活,但也有规律技巧可以借鉴.本文以不同 层次、不同难度的题目为学习进阶的载体,探究“两 步法”计算模型,引导学生读懂数据、发现规律、处 理数据,符合学生科学认知发展规律,有效提高学生 迁移理解能力、定量分析能力,帮助学生攻克平衡常数计算难题.
参考文献:
[1] 姜显光.高中化学反应限度学习进阶研究 [D].长春: 东北师范大学,2019.
[2] 杨丽琼,陈艺,马丹妮,等.“四步法”在化学分压平衡常数计算中的应用分析 [J].云南化工, 2021( 05) : 168 -170.
关注SCI论文创作发表,寻求SCI论文修改润色、SCI论文代发表等服务支撑,请锁定SCI论文网!
文章出自SCI论文网转载请注明出处:https://www.lunwensci.com/ligonglunwen/62874.html