SCI论文(www.lunwensci.com)
摘要:通过对高考平衡试题的分析,综合平衡常数计算的考试特点,总结了适用于水溶液平衡常数计算技巧,并结合高考实例进行了分析应用,以提高对水溶液中平衡常数计算的解题能力.
关键词:水溶液,图像,平衡常数,高中化学
1试题回顾与分析
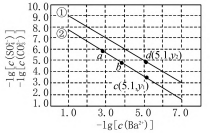
(2021·全国甲)已知相同温度下,Ksp(BaSO4)<Ksp(BaCO3).某温度下,饱和溶液中-lg[c(SO-)]、-lg[c(CO D.c(Ba2+)=10-5.1时两溶液中((=10y2-y1题目以难溶电解质BaCO3和BaSO4的溶解平衡为背景,给出了溶液中阴阳离子浓度负对数的平衡关系图.由题可知,曲线上的点均为饱和溶液中微粒浓度关系,因Ksp(BaSO4)<Ksp(BaCO3),则-lg[Ksp(BaCO3)]<-lg[Ksp(BaSO4)],则横坐标取相同的-lg[c(Ba2+)]时,纵坐标较大的为-lg[c(CO-)],纵坐标较小的为-lg[c(SO-)],
由此可知曲线①为代表BaSO4的沉淀溶解曲线,曲线②为代表BaCO3的沉淀溶解曲线.故A错误;曲线①为代表BaSO4的沉淀溶解曲线,由图可知,当溶液中-lg[c(Ba2+)]=3时,-lg[c(SO-)]=7,
则-lg[Ksp(BaSO4)]=7+3=10,因此Ksp(BaSO4)=1.0×10-10,故B正确;向饱和BaSO4溶液中加入适量BaCl2固体后,溶液中c(Ba2+)增大,根据温度不变则Ksp(BaSO4)不变可知,溶液中c(SO-)将减小,因此a点将沿曲线①向左上方移动,故C错误;由图可知,当溶液中c(Ba2+)=10-5.1时,两溶液中((==10y1-y2,故D错误.综上,此题答案为B.
2考点分析
从试题考察方向上分析,水溶液中的平衡偏重于考查水溶液中平衡移动的原理、微粒浓度的关系和平衡常数的计算,从近些年高考选择题水溶液中平衡试题选项设置中几乎都涉及平衡常数计算.因此平衡常数计算及其重要性.平衡常数计算归根结底还是考查分析图像的能力,并且能从图像找到平衡常数计算中涉及微粒的浓度关系的特殊点,根据平衡常数表达式考生自然就能解答此类问题.
3落实高考
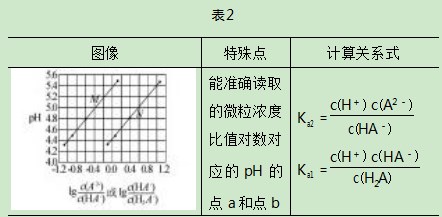
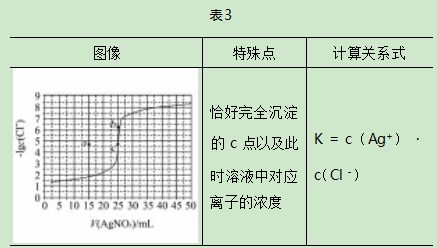
平衡常数计算技巧笔者综合历年高考中水溶液中平衡题,总结了高考试题中出现较多的图像类型以及涉及的平衡常数常用计算方法.第一,各微粒的分布系数变化图.此种图像首先根据题意判断随物质加入后溶液中各微粒对应的分布系数变化曲线,然后找到平衡常数表达式中所需微粒的分布系数曲线的交点(微粒分布系数相等,即浓度相等),从图像中读取此交点的pH,代入表达式计算平衡常数K;第二,溶液中微粒浓度比值的对数(负对数)随pH的变化图像.此种图像找到平衡常数表达式中所需的微粒浓度比值的对数(负对数)随pH的变化的线,在线上找到能准确读取比值的对数(负对数)对应的pH的点,代入关系式计算即可;第三,沉淀滴定曲线图.从沉淀滴定曲线中找到恰好达到沉淀溶解平衡的点,根据物质组成微粒关系找到此时溶液中对应离子的浓度,代入表达式计算即可.第四,酸碱中和滴定曲线.找到滴定曲线中未开始滴加碱(酸)的点,并找到这个点对应的pH,以已知浓度的HA酸为例,HA—H++A-,未滴加碱时c(H+)≈c(A-),HA酸为弱酸,电离程度小,因此c(HA)为初始浓度,将数据代入平衡常数公式即可计算.
4不同平衡图像的处理方式
综合平衡常数计算技巧,在不同平衡图像中找到特殊点进行计算.笔者将不同平衡图像的处理方法总结在表1、表2、表3和表4中.
5高考试题实例讲解
例1(2020·新课标Ⅰ)以酚酞为指示剂,用0.1000 mol·L-1的NaOH溶液滴定20.00 mL未知浓度的二元酸H2A溶液.溶液中,pH、分布系数δ随滴加NaOH溶液体积VNaOH的变化关系如图2所示.[比如A2-的分布系数:
δ(A2-)=c(A2-)]c(H2A)+c(HA-)+c(A2-)下列叙述正确的是().
A.曲线①代表δ(H2A),曲线②代表δ(HA-)
B.H2A溶液的浓度为0.2000 mol·L-1
C.HA-的电离常数Ka=1.0×10-2
D.滴定终点时,溶液中c(Na+)<2c(A2-)+c(HA-)
分析根据图像,曲线①代表的粒子的分布系数随着NaOH的滴入逐渐减小,曲线②代表的粒子的分布系数随着NaOH的滴入逐渐增大;当加入40.00 mL NaOH溶液时,溶液的pH发生突变,说明恰好完全反应,结合分析,根据反应
2 NaOH+H2 A———Na2 A+2 H2 O,c(H2 A)=0.1000 mol/L×40 mL 2×20.00 mLNaOH时,pH为1,说明=0.1000 mol/L;没有加入H2A第一步完全电离,第二步部分电离,曲线①代表δ(HA-),曲线②代表δ(A2-),HA-的电离平衡常数Ka=
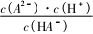
,当δ(HA-)=δ(A2-)时,溶液pH≈2,则Ka≈1×10-2.
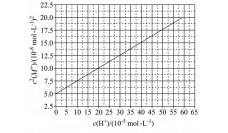
例2(2021·全国乙)HA是一元弱酸,难溶盐MA的饱和溶液中c2(M+)随c(H+)而变化,M+不发生水解.实验发现,298K时c2(M+)-c(H+)为线性关系,
如图3中实线所示.下列叙述错误的是().
A.溶液pH=4时,c(M+)<3.0×10-4mol·L-1
B.MA的溶度积度积Ksp(MA)=5.0×10-8
C.溶液pH=7时,c(M+)+c(H+)=c(A-)+c(OH-)
D.HA的电离常数Ka(HA)≈2.0×10-4分析Ksp(MA)=c(M+)c(A-),计算Ksp(MA)应找到c(M+)=c(A-)的点.由图可知,c(H+)=0时,可看作溶液中有较大浓度的OH-,此时A-的水解极大地被抑制,溶液中c(M+)=c(A-),则Ksp(MA)=c(M+)×c(A-)=c2(M+)=5.0×10-8;
根据Ka(HA)=
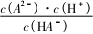
,计算Ka(HA)就需
找到当c(A-)=c(HA)时溶液中的c(H+),由物料守恒知c(A-)+c(HA)=c(M+),则c(A-

)=,Ksp(MA)=c(M+)×c(A-)=
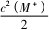
=5.0×10-8,则c2(M+)=10×10-8,对应图得此时溶液中c(H+)=2.0×10-4 mol·L-1,Ka(HA)=
c(H+)×c(A-)=c(H+)≈2.0×10-4.c(HA)
参考文献:
[1]人民教育出版社,课程教材研究所,化学课程教材研究开发中心.普通高中课程实验教科书·化[M].北京:人民教育出版社,2010.
关注SCI论文创作发表,寻求SCI论文修改润色、SCI论文代发表等服务支撑,请锁定SCI论文网! 文章出自SCI论文网转载请注明出处:https://www.lunwensci.com/jiaoyulunwen/70312.html

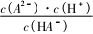 ,当δ(HA-)=δ(A2-)时,溶液pH≈2,则Ka≈1×10-2.
,当δ(HA-)=δ(A2-)时,溶液pH≈2,则Ka≈1×10-2.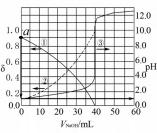
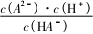 ,计算Ka(HA)就需
,计算Ka(HA)就需 )=,Ksp(MA)=c(M+)×c(A-)=
)=,Ksp(MA)=c(M+)×c(A-)=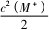 =5.0×10-8,则c2(M+)=10×10-8,对应图得此时溶液中c(H+)=2.0×10-4 mol·L-1,Ka(HA)=
=5.0×10-8,则c2(M+)=10×10-8,对应图得此时溶液中c(H+)=2.0×10-4 mol·L-1,Ka(HA)=