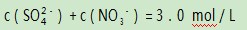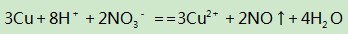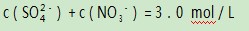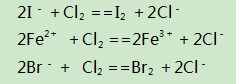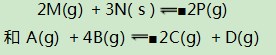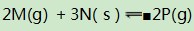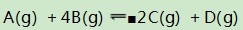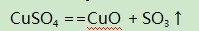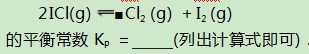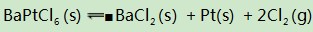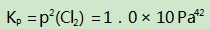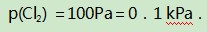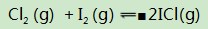SCI论文(www.lunwensci.com)
基于化学学科素养的化学计算题常常以化学基本概念和理论、元素化合物等知识为载体,重在考查学生的逻辑思维能力.有些计算题中各个数据之间存在着一定的制约关系,如某几种反应物的物质的量之和一定,或者两个量之间的比值为固定值.在解答过程中,要综合考虑物质间转化时的内在联系,在取值上要充分考虑这些制约条件,否则会使计算结果出现较大的偏差或完全相悖的结论.现举数例并进行浅析.
一、对不同反应物的总量加以制约
例1某稀溶液中含有硫酸和硝酸,已知:
现取200mL该混合溶液,加入a mol铜粉,铜粉完全溶解,则a的最大值为多少?
解析本题若只按稀硝酸和铜反应的化学方程式进行计算,则会得出错误的结果,这是因为反应后,生成Cu(NO3)2溶液,溶液中的NO3-在硫酸提供H+后,又能继续氧化铜粉.因此这类稀硝酸和稀硫酸混合酸中加入金属的计算,适宜用离子方程式求解,则可避免上述问题.
由于题中存在
这个制约条件,因此便将H2 SO4和HNO3之间建立了某种等量关系.另外,反应中消耗的铜的量受到溶液中的H+和NO3-共同制约.
由该离子方程式可知:
由离子方程式可知:
当NO3-有0.24mol时,最多能溶解0.36 mol铜,即a的最大值为0.36.
二、对反应物间用量的大小关系加以制约
例2常温下,将体积为Va、pH为a的硝酸与体积为Vb、pH为b的氢氧化钠溶液混合,恰好中和,已知Va<Vb和a=0.5 b.
请回答:
(1)a值可否等于3(填“可”或“否”),其理由是;
(2)a值可否等于5(填“可”或“否”),其理由是;
(3)求a的取值范围.
解析本题命题时在难度控制上采取循序渐进的形式,难度系数逐渐增大.该题设置的三个问题对应的内容紧密联系.第(1)问根据溶液的酸碱性即可判断,属于概念辨析问题,属于了解层次,只要注意a=0.5 b这个制约条件以及b>7这个隐含条件,多数考生可以轻松作答;第(2)问则需要通过计算推理,考查考生的计算能力,以及逻辑思维能力,属于理解和掌握层次,相较于第(1)问则加大了难度要求.即深入理解酸碱中和的基本原理,并且要对计算关系非常清楚.推导时要考虑到Va<Vb和a=0.5 b这两个制约条件;第(3)问则继续提升难度,上升到灵活应用层面.第(1)、(2)问主要是针对基本知识进行设问考查,而第(3)问则主要是对考生灵活运用知识解决实际问题进行考查,实则是考查了考生的逻辑思维能力,这样的命题方式,便使试题具备了良好的区分度.推导时要注意Va<Vb和b>7这些制约条件.
三、对同一反应物的总量加以制约
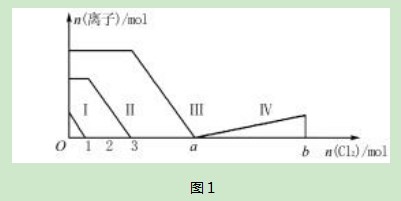
例3某溶液中含有Fe2+、I-、Br-,向该溶液中通入足量的Cl2时,溶液中四种微粒的物质的量变化情况如图1所示.若a+5=b,线段Ⅳ代表一种含氧酸,线段Ⅰ和Ⅳ代表的物质里含有某种相同的元素.下列描述正确的是().
A.线段Ⅱ代表的是Br-的变化情况
B.原溶液中FeI2和FeBr2的物质的量之比为3∶1
C.依图像无法求解a的值
D.线段Ⅳ代表的是IO3-的变化情况
解析根据还原性强弱关系:I->Fe2+>Br-,向混合溶液中通入氯气后,I-、Fe2+、Br-依次被氧化,相应的离子反应为:
由此可知:线段Ⅰ、Ⅱ、Ⅲ代表的分别是I-、Fe2+、Br-按照上述离子方程式被Cl2氧化的情况.横坐标0-1,即通入1 mol Cl2时,能氧化2mol I-,即溶液中n(I-)=2mol;横坐标1-3,又通入2mol Cl2,用来氧化Fe2+,则溶液中n(Fe2+)=4 mol;此时要挖掘出题目中隐含的I-、Fe2+、Br-三种离子间的制约条件:即三者之间存在的电荷守恒关系,n(I-)+n(Br-)=2n(Fe2+),可得出n(Br-)=6 mol,氧化6 mol Br-又需要3 mol Cl2,则横坐标a=6,可以求出原溶液中FeI2和FeBr2的物质的量之比为1∶3,因此选项A、B、C均错误.由题意知,线段Ⅳ代表的是含碘元素的微粒,再根据另一个制约条件:a+5=b,即a点之后又通入5 mol Cl2,用来氧化1 mol I2,根据得失电子守恒可知:碘元素后来的化合价为+5价,即为IO3-,故D项正确.
答案为D.
四、对气体反应物的总压加以制约
例4在一个恒容密闭容器中,内部有一个可左右自由滑动的隔板,将容器分成左右两部分.左、右两室分别进行可逆反应:
起始时各物质的相关数据:M、N、P分别为2.5 mol、3.0 mol、1.0 mol.A、C、D分别为0.5 mol,B的物质的量为x mol.当x取不同数值时,可以采用调节反应器温度的方式,使左右两室内的反应均达到平衡状态,此时隔板恰好位于反应器的正中间位置.达到平衡后,已知N的转化率为75%,回答下列问题:
(1)达到平衡后,反应器左室气体总的物质的量为mol;
(2)若要使右室反应开始时v(正)>v(逆),则x的取值范围是;
(3)若要使右室反应开始时v(正)<v(逆),则x的取值范围是.
解析本题属于化学平衡的计算问题,根据“两个反应均达到平衡状态,且使隔板位于反应器的正中间位置”这一已知条件,再结合阿伏加德罗定律分析,本题的制约条件即为:两侧反应达平衡后,两室气体的物质的量必然相等!故解题时要依据这一条件进行计算.
(1)容器左室反应:
观察此反应可以发现:该反应在进行过程中,容器内混合气总物质的量始终保持不变,即3.5 mol.
(2)右室反应式:
此反应的特点是:正向反应过程中,气体的总量减少.若要求反应开始时v(正)>v(逆),即向正向进行,采用极限思维分析:假设反应进行的程度为零,即x有最小值2,若反应进行到底,令A完全反应,则x有最大值,根据反应式有:
(3)同理:若开始反应向逆向进行,设反应的程度为零,则x有最大值2,若令0.5 mol C完全反应,则可求x的最小值为1.5,故x的取值范围是:1.5<x<2.
答案:(1)3.5;
(2)2.0<x<3.0;
(3)1.5<x<2.
五、对物质的质量变化加以制约
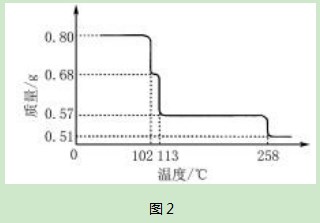
例5取0.80 g CuSO4·5H2 O晶体样品,对其加热,反应过程中样品质量随温度的变化趋势如图2所示:
(1)在200℃时所得固体物质的化学式为(写出推理过程);
(2)取270℃时所得样品,在570℃时进行灼烧,得到黑色粉末和一种氧化性气体,该过程对应的反应式为.将该黑色粉末加入到稀硫酸中进行溶解后,经蒸发浓缩、冷却,发现有晶体析出,写出该晶体的化学式,该晶体存在的最高温度为.
解析(1)观察图像可知,加热到102℃时,CuSO4·5H2 O开始脱水分解,到113℃时,得到一种中间产物,再接着加热到258℃时才会继续分解.在200℃时结晶水尚未完全失去,失去的水的质量为0.80g-0.57g=0.23g,依据脱水反应进行计算:
因此可知:在加热到200℃时得到固体物质为CuSO4·H2 O
(2)采用同样的计算方法,可求得258℃时完全失水,所得固体物质为无水CuSO4,即570℃灼烧时应该是CuSO4发生了分解,黑色粉末应该为CuO,氧化性气体是SO3,该过程的化学方程式为:
把CuO溶解于稀硫酸中,得到硫酸铜溶液,经蒸发浓缩、再冷却,析出晶体CuSO4·5H2 O,其存在的最高温度为102℃.
评注热重分析类型的计算题,加热初期都是分阶段的失水,可以按失水反应式求解阶段产物.失去全部结晶水后再升温,即开始分解,可以结合题给信息分析推理所得产物,写出对应的反应式.
六、多重平衡体系互相制约
例6对氯铂酸钡(BaPtCl6)固体进行加热,固体部分分解,产物为BaCl2、Pt和Cl2,376.8℃时平衡常数KP=1.0×104 Pa2.在一硬质玻璃烧瓶中加入过量BaPtCl4,抽真空后,通过一支管通入碘蒸气(然后将支管封闭).在376.8℃,碘蒸气初始压强为20.0kPa.376.8℃平衡时,测得烧瓶中压强为32.5kPa,则p(ICl)=kPa,反应
解析BaPtCl6固体加热时分解反应为:
该反应的平衡常数
进一步得出达平衡状态时,
容器中还同时发生另一个可逆反应:
此反应和上述平衡共存于同一个容器中,既相互依存又相互制约.两个平衡中通过氯气联系在一起,需要注意的是达平衡后,p(Cl2)=0.1 kPa是不变的.
假设参加反应的I2(g)为x kPa,依据下面计算方式求解:
关注SCI论文创作发表,寻求SCI论文修改润色、SCI论文代发表等服务支撑,请锁定SCI论文网! 文章出自SCI论文网转载请注明出处:https://www.lunwensci.com/jiaoyulunwen/66524.html