SCI论文(www.lunwensci.com):
[摘要]目的:构建针对核受体结合SET结构域蛋白2(nuclear receptor binding SET domain protein 2,NSD2)的短发夹干扰RNA(short hairpin RNA,shRNA)慢病毒干扰载体,建立稳定干扰NSD2基因的MDA-MB-231三阴乳腺癌细胞株。方法:构建2条针对人源NSD2基因的shRNA(shNSD2-1#和shNSD2-2#),连接到慢病毒载体(pGLV10/U6/RFP/Puro)并进行测序鉴定。将NSD2 shRNA慢病毒载体与包装质粒共转染到293T细胞,慢病毒包装后进行滴度检测。将包装好的慢病毒转染至三阴乳腺癌MDA-MB-231细胞中,嘌呤霉素筛选建立稳定转染NSD2 shRNA的细胞株。采用real-time PCR检测NSD2 mRNA的表达变化,蛋白质印迹法检测NSD2及其特异性催化的组蛋白甲基化标志物H3K36me2蛋白水平的表达变化。结果:成功构建两个NSD2 shRNA慢病毒干扰载体;与阴性对照组相比,shNSD2-1#组和shNSD2-2#组MDA-MB-231细胞中NSD2 mRNA和蛋白水平均显著下调,NSD2催化的H3K36me2蛋白表达也随之下调。结论:本研究成功建立了shRNA慢病毒载体介导的稳定敲低NSD2的MDA-MB-231细胞株,证实干扰NSD2基因表达能有效抑制其对组蛋白H3K36的甲基化作用,为进一步研究NSD2在乳腺癌中的作用机制奠定了基础。
[关键词]NSD2;三阴乳腺癌;RNA干扰;慢病毒
Establishment of a Triple-negative Breast Cancer Cell Line with Stable Knockdown of NSD2 Gene via
Lentivirus-mediated Interference
LIU Xiumin1,PAN Yun1,Ning Chunmeng2,GAO Bo1
(1.Department of Pathology,First Affiliated Hospital of Dali University,Dali Yunnan 671000;
2.Basic Medical College of Dali University,Dali Yunnan 671000,China)
Abstract Objective:To construct two shRNA lentiviral vectors targeting NSD2(nuclear receptor binding SET domain protein 2)gene and establish a triple-negative breast cancer cell line with stable knockdown of NSD2.Methods:Two shRNA sequences targeting NSD2 gene(shNSD2-1#and shNSD2-2#)were designed,synthesized and cloned into a lentiviral vector(pGLV10/U6/RFP/Puro).Positive clones confirmed by DNA sequencing.Subsequently,NSD2 shRNA lentiviral vector and packing plasmids were co-transfected into 293T cells.fte titer of virus was detected according to the expression of red fluorescence protein(RFP).MDA-MB-231 cells were transfected with the packaged lentiviral vector,and the stable cell lines with NSD2 knockdown were obtained after puromycin-resistance screening.The mRNA level of NSD2 was detected by real-time PCR.Western blot was performed to detect the protein level of NSD2 and its downstream target,H3K36me2.Results:Two specific lentiviral RNAi vector targeting NSD2 gene were successfully constructed.Compared to the negative group,the mRNA and protein levels of NSD2 were significantly reduced in shNSD2-1#group and shNSD2-2#group.NSD2-catalyzed H3K36me2 was also downregulated.Conclusion:fte MDA-MB-231 cell line with stable knockdown of NSD2 is constructed successfully.fte knockdown of NSD2 efficiently suppressed its function of methylating H3K36,providing a foundation for further studying the role and mechanism of NSD2 in breast cancer.
Keywords NSD2;triple-negative breast cancer;RNA interference;lentivirus
核受体结合SET结构域蛋白2(nuclear receptor binding SET domain protein 2,NSD2)又名多发性骨髓瘤SET结构域蛋白(multiple myeloma SET domain,MMSET)或Wolf Hirschhom综合征候选基因1(Wolf Hirschhom syndrome candidate 1,WHSC1),与核受体结合SET结构域蛋白1(nuclear receptor binding SET domain protein 1,NSD1)和核受体结合SET结构域蛋白3(nuclear receptor binding SET domain protein 3,NSD3)共同组成NSD组蛋白甲基转移酶家族。NSD2基因位于染色体4p16.3上,全长120 kb,经选择性剪切后主要形成3种转录本即MMSET type I,MMSET type II和RE-IIBP[1]。NSD 2含有SET结构域,且具有高度保守性,它主要通过特异性地催化H3K36二甲基化,发挥转录活化功能[2-3]。最初发现NSD2在频发染色体t(4;14)易位的多发性骨髓瘤中高表达。随后也证实NSD2在前列腺癌、宫颈癌和头颈部鳞状细胞癌等多种肿瘤中出现高表达,且其高表达与肿瘤的侵袭及患者的不良预后有关[4-6]。研究[7-8]显示:NSD2与雌激素受体α(estrogen receptorα,ERα)阳性表达的乳腺癌内分泌治疗耐药相关。然而NSD 2在三阴乳腺癌(tr iple-negative breast cancer,TNBC)中的作用尚未明确,本研究旨在构建并鉴定NSD2 shRNA慢病毒干扰载体,对三阴乳腺癌MDA-MB-231细胞进行转染,筛选构建稳定干扰NSD2基因的MDA-MB-231细胞株,为进一步研究NSD2在TNBC中的生物学功能和作用机制奠定基础。
1材料与方法
1.1材料
MDA-MB-231乳腺癌细胞株购自中国科学院典型培养物保藏委员会昆明细胞库,人胚肾细胞293T为本室保存,慢病毒载体及包装系统(重组穿梭质粒pGLV10/U6/RFP/Puro和包装质粒pGag/Pol,pRev,pVSV-G)购自上海吉玛制药技术有限公司。DMEM培养基和胎牛血清购自美国Gibco公司;胰酶购自美国Millipore公司;转染试剂RNAi-Mate和转染增强剂聚凝胺(Polybrene)购自上海吉玛制药技术有限公司;嘌呤霉素购自美国Sigma公司;总RNA提取试剂盒、Fasting cDNA第一链合成试剂盒、Talent荧光定量检测试剂盒购自天根生化科技有限公司;PCR引物由苏州金唯智生物科技有限公司合成;抗NSD 2鼠单克隆抗体(ab 75359)购自英国Abcam公司;抗H3K36me2兔单克隆抗体(#2901)购自美国Cell Signaling Technology公司;抗β-actin鼠单克隆抗体(C W 0096)、HRP标记的山羊抗兔Ig G(CW0103)、HRP标记的山羊抗小鼠Ig G(CW0102S)、RIPA裂解液、蛋白酶抑制剂、SDS-PAGE凝胶制备试剂盒均购自康为世纪生物科技有限公司;PVDF膜、ECL化学发光显影液购自美国Millipore公司。
1.2NSD2 shRNA慢病毒表达载体的构建与鉴定
检索Ge nB a nk中人类NS D 2基因mR NA序列(NM_133330.2),根据shRNA设计原则,设计2条干扰靶点序列和1条阴性对照(Negative control,N C)序列,并合成其shR NA,靶点序列分别为shNSD2-1#(5'-GCTATTGAAACCAATTTCA-3')、shNSD2-2#(5'-GCACGCTACAACACCAAGTTT-3')和shNC(5'-TTCTCCGA ACGTGTCACGT-3')。将合成的shRNA DNA单链退火形成双链,利用T4噬菌体DNA连接酶将酶切后的慢病毒穿梭质粒与退火后的双链DNA进行连接反应,将连接后产物转化至感受态细胞DH5α,摇菌后接种于含有100μg/mL氨苄青霉素的LB琼脂培养基,37℃培养16 h,随机挑选单克隆,并扩大培养,进行菌落PCR鉴定实验,并将PCR阳性克隆进行测序鉴定。
1.3慢病毒载体包装
将293T细胞接种到15 cm培养皿中,待细胞融合度达80%~90%时进行病毒包装,将含有目的序列的穿梭质粒和包装质粒(pGag/Pol,pR ev,pVSV-G)经转染试剂RNAi-Mate共转染进293T细胞,6 h后将转染液换成10%FBS的DMEM培养基继续培养。72 h后将细胞培养上清液收集起来,0.45μm滤器过滤、超速离心获得病毒浓缩液,分装后保存于−80℃备用。
1.4慢病毒滴度测定
将293T细胞以3×104个/孔接种于96孔板中,待第2天细胞贴壁,用含10%FBS的DMEM培养基将慢病毒原液倍比稀释成5个梯度(1:10,1:102,1:103,1:104,1:105)后感染细胞,24 h后换液,72 h后通过荧光显微镜观察计数表达报告基因(RFP)的红色荧光细胞,计算病毒滴度。病毒滴度计算公式:病毒滴度(Tu/mL)=荧光细胞比例×转染时的细胞数×相应稀释倍数。
1.5慢病毒感染及稳定表达NSD2-shRNA的细胞株筛选
将MDA-MB-231细胞以密度为1.5×105个/孔接种于6孔板中,隔天细胞贴壁后,以感染复数(MOI)为20的阳性重组慢病毒和对照重组慢病毒感染细胞,同时每孔添加终浓度为5μg/mL的Polybrene。24 h后更换含10%FBS的DMEM培养基,72 h后观察红色荧光强度,添加终浓度为1μg/mL的嘌呤霉素筛选阳性细胞2周,real-time PCR和蛋白质印迹法检测NSD 2的mR NA和蛋白表达,确定NSD 2干扰慢病毒的敲低效率后扩大培养冻存保种。
1.6Real-time PCR检测NSD2 mRNA表达
收集细胞,根据总R NA提取试剂盒说明提取总RNA,使用核酸蛋白测定仪检测RNA浓度。根据天根Fasting cDNA第一链合成试剂盒说明书将R NA反转录成cDNA,按照Ta l ent荧光定量检测试剂盒说明书配制P CR反应液,使用Bi o-R ad CFX96型荧光定量P CR仪进行P CR反应。NSD 2引物序列为:5'-ACTCCTCAAAAGACGGCAGA-3'(正向引物),5'-TGGTGTTGTAGCGTGCTCTC-3'(反向引物)。内参G A PDH引物序列为:5'-TGCACCACCAACTGCTTAGC-3'(正向引物),5'-G G C ATG G ACTGTG GTC ATG AG-3'(反向引物)。反应条件为:95℃预变性3 min,95℃变性5 s,60℃退火/延伸15 s,共40个循环。实验重复3次,以2−ΔΔCt法计算NSD2 mRNA相对表达量。
1.7蛋白质印迹法检测NSD2及H3K36me2蛋白表达
收集细胞,使用蛋白酶抑制剂和RIPA裂解液1:100的混合物裂解细胞提取总蛋白,BCA法测定各样本蛋白浓度,将蛋白样品和5×loading buffer以1:4比例混合再进行金属浴变性。将制备好的蛋白样品进行SDS-PAGE电泳,并采用半干转的方式将电泳分离好的目的蛋白转印到PVDF膜上,用含5%脱脂奶粉的TBST室温封闭1 h。分别加NSD2,H3K36me2,β-actin抗体(均以1:1 000稀释)4℃孵育过夜。TBST洗膜10min×3次,二抗(1:2 000稀释)室温孵育1 h。TBST洗膜10 min×3次,ECL化学发光显影检测目的蛋白。
1.8统计学处理
采用SPSS 21.0统计学软件进行数据分析。数据采用均数±标准差(x±s)表示,两组数据比较采用两独立样本t检验分析,P<0.05为差异有统计学意义。
2结果
2.1慢病毒重组质粒测序鉴定
3个重组慢病毒质粒p G L V 1 0-s h R N A-NSD2-1#(shNSD2-1#),pGLV10-shRNA-NSD2-2#(shNSD2-2#),pGLV10-shRNA-NC(shNC)经测序鉴定证实,插入的DNA序列与设计的序列完全一致,无碱基突变(图1),表明慢病毒质粒构建成功。2.2慢病毒载体的包装及滴度测定将shNSD2-1#,shNSD2-2#,shNC质粒分别与包装质粒在RNAi-Mate作用下共转染293T细胞,24 h后显微镜下可见细胞生长状态良好,继续培养72 h后荧光显微镜下可观察到红色荧光。将收集慢病毒原液用梯度稀释法测定病毒滴度,shNSD2-1#为4×108 TU/m L,sh NSD 2-2#为5×108 TU/m L,shNC为1×109 TU/mL。
2.3稳定干扰NSD2细胞株的建立
将携带NSD 2特异性干扰序列的慢病毒和对照病毒感染乳腺癌MD A-MB-231细胞,72 h后荧光显微镜下观察到shNSD2-1#,shNSD2-2#和shNC组均可见红色荧光表达,强度较高且比例近80%(图2)。随后,利用嘌呤霉素筛选富集阳性细胞,继续培养得到稳定干扰NSD 2基因的MDA-MB-231细胞株。
2.4Real-time PCR鉴定干扰效果
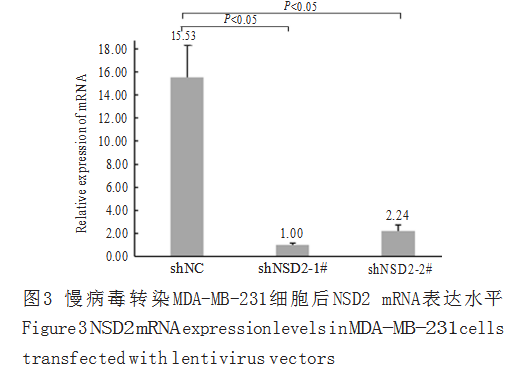
慢病毒转染MDA-MB-231细胞稳定筛选2周后,分别收集对照组和NSD 2干扰组细胞提取总RNA,real-time PCR检测NSD2 mRNA表达水平。结果显示,对照组NSD2 mRNA的相对表达值为15.53±2.755,而shNSD2-1#组和shNSD2-2#组的相对表达值分别为1.00±0.182,2.24±0.529(图3),表明NSD 2的两条特异性干扰序列均能显著下调NSD2 mRNA表达,shNSD2-1#、shNSD2-2#的干扰效率分别为93.5%(P=0.032)和85.5%(P=0.037),
差异均具有统计学意义。
2.5蛋白质印迹法鉴定干扰效果
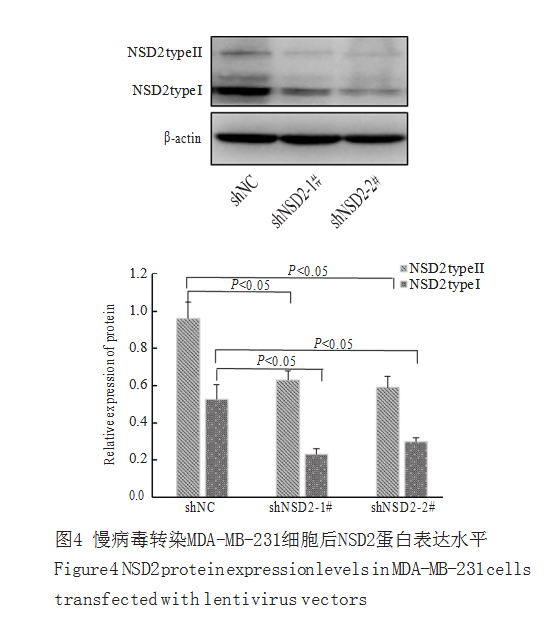
慢病毒转染MDA-MB-231细胞稳定筛选2周后,分别收集对照组和NSD2干扰组细胞提取总蛋白,蛋白质印迹法检测NSD2蛋白表达水平。结果显示:NSD2的两条特异性干扰序列均能有效下调NSD2蛋白type I和type II的表达,且差异具有统计学意义(P<0.05,图4)。
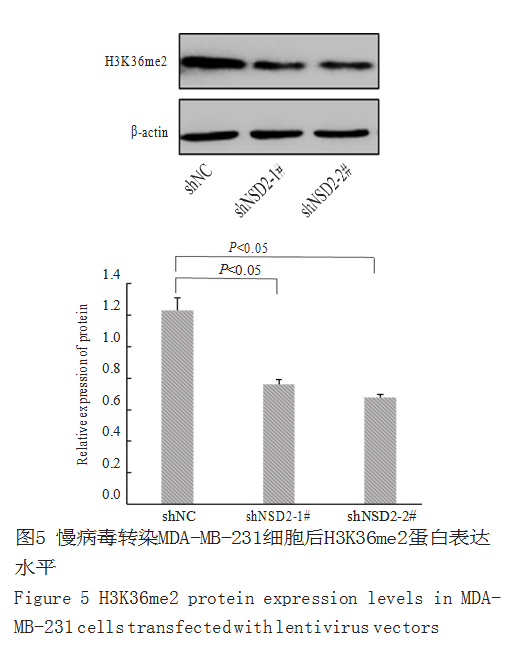
稳定干扰 NSD2 对其甲基化作用的影响蛋 白 质 印 迹 法 结 果 显 示 s h N S D 2 - 1 # , shNSD2-2# 干扰组细胞中H3K36me2 蛋白表达下调,差异具有统计学意义(P<0.05,图5)。
3 讨论
乳腺癌是女性最常见的恶性肿瘤之一,近年来乳腺癌的发病率逐渐上升,且发病年龄呈现年轻化的趋势。TNBC占乳腺癌的15%~20%,是雌激素受体(estrogen receptor,ER)、孕激素受体(progesterone receptor,PR)和人类表皮生长因子受体-2(human epidermal growth factor receptor-2,HER-2)均呈阴性表达的一种亚型。TNBC多发于青年女性,肿块较大,组织学分级高,局部淋巴结阳性者较多,内脏和中枢神经系统转移早,预后差,病死率高[9]。TNBC是乳腺癌治疗中最棘手的亚群,无法从内分泌治疗和以HER-2为靶点的曲妥珠单抗治疗中获益,除手术外,仍以化疗为主要治疗方式。缺乏有效的靶向治疗手段、化疗敏感性低及耐药使得TNBC患者的5年无病生存率和总生存率均显著低于非TNBC患者[9]。发现可用于预后监测的分子标志物和可干预的治疗新靶点,是TNBC研究领域亟待解决的问题。表观遗传学研究表明乳腺癌的发生与表观遗传修饰密切相关。近年来表观遗传修饰成为分子病理研究的热点,而组蛋白甲基化修饰作为表观遗传修饰的重要组成部分也随之成为了一个重要的研究方向。从组蛋白甲基化修饰方面研究乳腺癌的发病机制,探究对诊断、预后有重要价值的组蛋白甲基转移酶的功能,对于研发新的乳腺癌分子靶向治疗手段具有十分重要的意义。
N S D 2基因在多种实体肿瘤中高表达,且NSD 2的高表达与肿瘤的侵袭、转移及较差预后密切相关。Yang等[10]通过免疫组织化学方法分析了132例浆液性卵巢癌中NSD 2的表达情况,其中65例(49.2%)的病例中观察到NSD 2高表达,并且与浆液性卵巢癌疾病进展及较差的预后相关。同样在骨肉瘤中,Lu等[11]发现了NSD 2的异常高表达,且NSD2通过抑制E-钙黏蛋白和诱导上皮间质转化促进骨肉瘤细胞的侵袭。NSD2不仅通过催化H3K36二甲基化参与肿瘤的发生发展,其功能获得性突变也具有重要的致癌作用。在部分儿童急性淋巴细胞白血病中,NSD2第1 099位谷氨酸突变为赖氨酸,该突变抑制了癌细胞的凋亡,增强了癌细胞的增殖、黏附、迁移及克隆形成能力[12]。
MicroRNA是表观遗传学中的重要调控分子,NSD2也是多个microRNA发挥作用的关键靶点。Li等[13]研究发现抑癌因子miR-2392在胃癌中呈现低表达,与NSD 2及MAML3的高表达密切相关,过表达miR-2392显著下调E-钙黏蛋白的转录抑制因子Slug及Tw ist1,同时靶向作用于NSD2和MAML3,抑制上皮间质转化。Chen等[14]证实上调miR-154能降低靶基因NSD 2的表达,并阻断p53途径,抑制人鳞状皮肤细胞癌的增殖,诱导其凋亡。
目前,NSD2在ER阳性的乳腺癌中研究较多。ERα是乳腺细胞增殖和凋亡的重要调控因子。有研究[7]显示:NSD 2在ERα信号转导通路中发挥正向调控作用,其与BRD3和BRD4蛋白协同作用促使ERα在乳腺癌中高表达,提示NSD 2在ERα阳性乳腺癌的内分泌治疗中具有重要作用。而在他莫昔芬耐药乳腺癌中,Wang等[8]通过基因表达谱和免疫组织化学分析发现NSD2呈高表达,并且与乳腺癌复发、生存率低相关,进一步证实NSD2通过改变乳腺癌细胞的糖代谢过程,引起内分泌治疗耐药,提示NSD2可作为他莫昔芬耐药乳腺癌的治疗靶点。然而,NSD2在无法进行内分泌治疗的三阴乳腺癌中的生物学功能和作用机制尚不明确,值得深入研究。
RNA干扰(RNA interference,RNAi)是指由双链RNA介导的,由多种酶参与降解细胞内同源mRNA,以阻断体内靶基因表达,阻断基因表达多发生在转录水平、转录后水平以及翻译水平。现该项技术在研究疾病的发生机制、基因的功能和肿瘤的基因治疗等领域被广泛应用[15]。其主要的干扰方法有直接转染小干扰RNA(siRNA)和构建短发卡RNA载体(shRNA)两种。而相较于siRNA介导的瞬时RNAi,稳定整合的shRNA通过使用抗生素选择标记表达载体可以长期稳定敲低基因表达[16]。慢病毒载体介导的RNAi较其他形式的载体转染效率高,能感染分裂和非分裂状态的细胞,可将携带的外源shRNA整合到宿主基因组中,且稳定持久表达,因此适合用于构建稳定沉默目的基因的细胞株。
本研究针对人源NSD 2设计了2条干扰序列,采用的慢病毒载体可以表达RFP和Puro抗性,慢病毒感染MDA-MB-231细胞,荧光显微镜下观察可见RFP表达,且经嘌呤霉素筛选得到阳性细胞,real-time PCR和蛋白质印迹法证实2条shRNA均能明显下调NSD2 mRNA和蛋白水平。H3K36me2是介导NSD 2发挥促癌作用的关键的组蛋白修饰形式,本研究进一步证实感染NSD2 shRNA慢病毒后,H3K36me2蛋白表达明显降低,表明成功抑制了NSD2催化该组蛋白位点发生甲基化的功能。综上,本研究成功构建了shRNA慢病毒载体介导的稳定敲低NSD2的MDA-MB-231细胞株,为后续深入研究NSD2在三阴乳腺癌中的生物学作用及上下游调控机制奠定了基础。
参考文献
1.Xie Z,Chng WJ.MMSET:Role and therapeutic opportunities in multiple myeloma[J].Biomed Res Int,2014,2014:636514.
2.Yuan G,Ma B,Yuan W,et al.Histone H2A ubiquitination inhibits the enzymatic activity of H3 lysine 36 methyltransferases[J].J Biol Chem,2013,288:30832-30842.
3.Morishita M,Mevius D,di Luccio E.In vitro histone lysine methylation by NSD1,NSD2/MMSET/WHSC1 and NSD3/WHSC1L[J].BMC Struct Biol,2014,14:25.
4.Aytes A,Giacobbe A,Mitrofanova A,et al.NSD2 is a conserved driver of metastatic prostate cancer progression.[J].Nat Commun,2018,9(1):5201.
5.Yin Z,Sun Y,Ge S,et al.Epigenetic activation of WHSC1 functions as an oncogene and is associated with poor prognosis in cervical cancer[J].Oncol Rep,2017,37(4):2286-2294.
6.Saloura V,Cho HS,Kiyotani K,et al.WHSC1 promotes oncogenesis through regulation of NIMA-related kinase-7 in squamous cell carcinoma of the head and neck[J].Mol Cancer Res,2015,13(2):293-304.
7.Feng Q,Zhang Z,Shea MJ,et al.An epigenomic approach to therapy for tamoxifen-resistant breast cancer[J].Cell Res,2014,24(7):809-819.
8.Wang J,Duan Z,Nugent Z,et al.Reprogramming metabolism by histone methyltransferase NSD2 drives endocrine resistance via coordinated activation of pentose phosphate pathway enzymes[J].Cancer Lett,2016,378(2):69-79.
9.杜娟,阮祥燕.三阴乳腺癌的特点及研究进展[J].首都医科大学学报,2015,36(4):578-582.
DU Juan,RUAN Xiangyan.Features and research progressions in triple negative breast cancer[J].Journal of Capital Medical University,2015,36(4):578-582.
10.Yang S,Zhang Y,Meng F,et al.Overexpression of multiple myeloma SET domain(MMSET)is associated with advanced tumor aggressiveness and poor prognosis in serous ovarian carcinoma[J].Biomarkers,2013,18(3):257-263.
11.Lu MH,Fan MF,Yu XD.NSD2 promotes osteosarcoma cell proliferation and metastasis by inhibiting E-cadherin expression[J].Eur Rev Med Pharmacol Sci,2017,21(5):928-936.
12.Swaroop A,Oyer JA,Will CM,et al.An activating mutation of the NSD2 histone methyltransferase drives oncogenic reprogramming in acute lymphocytic leukemia[J].Oncogene,2019,38(5):671-686.
13.Li J,Li T,Lu Y,et al.MiR-2392 suppresses metastasis and epithelial-mesenchymal transition by targeting MAML3 and WHSC1 in gastric cancer[J].FASEB J,2017,31(9):3774-3786.
14.Chen HQ,Gao D.Inhibitory effect of microRNA-154 targeting WHSC1 on cell proliferation of human skin squamous cell carcinoma through mediating the P53 signaling pathway[J].Int J Biochem Cell Biol,2018,100:22-29.
15.张鑫,郝玉琴.RNA干扰技术的研究进展[J].中国麻风皮肤病杂志.2016,32(2):119-122.
ZHANG Xin,HAO Yuqin.Update of RNA interference technology[J].China journal of Leprosy and Skin Diseases,2016,32(2):119-122.
16.Moore CB,Guthrie EH,Huang MT,et al.Short hairpin RNA(shRNA):Design,delivery,and assessment of gene knockdown[J].Methods Mol Biol,2010,629:141-158.
关注SCI论文创作发表,寻求SCI论文修改润色、SCI论文代发表等服务支撑,请锁定SCI论文网! 文章出自SCI论文网转载请注明出处:https://www.lunwensci.com/jiaoyulunwen/10994.html