SCI论文(www.lunwensci.com):
摘要:颅内动脉粥样硬化性狭窄是全世界卒中最常见的原因,与复发性卒中高风险明显相关。与白人相比,黑人、西班牙裔和亚洲人中更为流行。目前的研究显示,积极的药物治疗仍然是颅内动脉粥样硬化性狭窄患者主要治疗方式,然而对于复发性卒中患者在积极的药物治疗失败后该选择怎样的治疗方案仍存在争议。本文对颅内动脉粥样硬化狭窄性改变成像方式和治疗现状进行介绍,更好地识别高危患者,制定有效的治疗方案。
关键词:颅内动脉粥样硬化性狭窄;缺血性卒中;成像方式和治疗
本文引用格式: 陈兰娟 , 杨晓帆 , 邵长宇 , 等 . 颅内动脉粥样硬化性狭窄的成像方式和治疗现状 [J]. 世界最新医学信息文摘 ,2018,18(76):109-111.
0引言
近年来,全球卒中的负担越来越大,并逐年在增加。据估计,全球每 100000 人中就有 20 到 40 人患有与颅内动脉粥样硬化性狭窄相关的缺血性脑血管事件。颅内动脉粥样硬化性狭窄已被认为是全世界中风最常见的原因,并且与复发性卒中息息相关 [1]。常规的血管成像方式如数字减影血管造影(DSA)、CT 血管造影(CTA)、磁共振血管成像(MRA)等,可用于临床识别颅内动脉粥样硬化性狭窄。随着 MR 技术的发展,高分辨磁共振技术逐渐进入研究者的视野,有效识别血管狭窄的同时可详细的观察管腔及血管壁的改变。在治疗上,单独服用阿司匹林或华法林时,第一年复发性卒中风险约为 20%,因此积极的药物治疗,包括双重抗血小板治疗和强化风险因素管理非常重要。然而,复发性卒中患者在失败的药物治疗后该选择怎样的治疗方案呢?本文对颅内动脉粥样硬化狭窄性改变成像方式和治疗现状进行介绍,更好地识别高危患者,制定有效的治疗方案。
1颅内动脉粥样硬化性改变的卒中机制
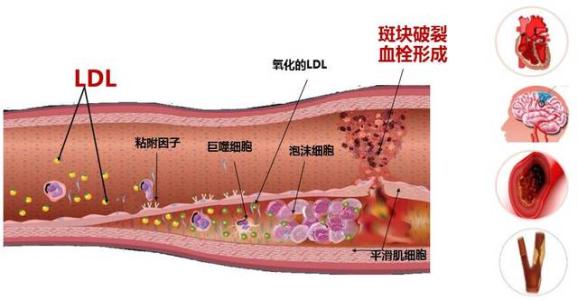
颅内动脉粥样硬化致缺血性脑卒中有几种可能的机制: 动脉到动脉栓塞,低灌注栓子清除率下降和穿支动脉粥样硬化性疾病。不同机制预示着不同的复发率、对治疗的反应和预后,可通过神经影像学上梗死模式来推断具体机制[2]。梗塞模式可分为:A. 穿支 - 皮质下梗死型:在颅内动脉狭窄部位出现穿支动脉狭窄或闭塞。B. 区域模式型:狭窄血管远端的梗塞(皮质、皮质下或两者均有),仅限于由该动脉供应的领土。C. 分水领梗塞:在血管交界区(放射冠或半卵圆中心)或皮质交界区(大脑中动脉与大脑后动脉之间或大脑中动脉和大脑前动脉之间或两者兼而有之)。D. 混合模式:任何上述类型的组合。动脉 - 动脉栓塞或原位血栓闭塞是区域模式的可能机制;狭窄部位穿支开口或多穿支开口闭塞是穿支梗塞的机制;分水岭区低灌注和混合机制可解释混合类型的梗塞。在 WASID 试验中,符合标准的卒中患者中区域性梗死占 50.7,穿支 - 皮质下梗死类型 25%,混合 15.5%,交界区占 8.8%。动脉到动脉在前循环较为多见,而穿支血管闭塞在后循环中更为常见 [3]。
2成像方式
数字减影血管造影(DSA)被认为是量化血管狭窄和评估侧支血流的金标准,并且有助于颅内血管成形术、支架置入术或脑动脉 - 硬脑膜动脉脑动脉 - 硬脑膜动脉患者的选择。由于高的空间分辨率,DSA 已被广泛用于评估颅内动脉粥样硬化性改变。缺点包括高成本、有限的可用性和严重的围手术期并发症的风险。在缺血性卒中急性期,DSA 仅用于动脉内再通患者的选择,而不用于临床诊断。DSA 还可以提供有价值的侧支血流信息。最近发表的一项前瞻性研究, 在中国人群中,基于 DSA 所证实存在血流动力学障碍,并且ASITN/SIR 侧枝评分 <3 分的患者进行颅内动脉支架置入术。结果发现术后 30 天卒中、短暂性脑缺血发作 (TIA) 或死亡的发生率仅为 5%[4],显著低于SAMPRIS 和 VISSET 试验 30 天终点事件发生率(分别为 15% 和 24%)[5-6]。与此同时,DSA是动脉粥样硬化性狭窄患者支架置入后的评估最准确、安全的方式,而 CTA 和 MRA 等往往受到支架产生伪影的限制。
和 DSA 相比,CT 血管造影侵入性小、更快速,在临床上的应用更广泛。CT 血管造影在评估血管狭窄程度时具有较高的操作者之间的可靠性,与 MRI 技术相比,它不易受到运动伪影的影响。缺点是辐射暴露和造影剂使用的必要性,在某些情况下可导致过敏反应和肾脏疾病。由于有限的空间分辨率,CT 血管造影也不适合描述直径小于0.7 毫米的血管。总体而言,研究表明 CTA 可作为识别颅内动脉粥样硬化性狭窄和闭塞的筛查工具,在许多情况下可替代 DSA 的使用。然而,一些研究报告显示与 DSA 相比,CTA 的 PPV 较低,研究者认为可能仍需要 DSA 的证实 [7]。新的 CTA 技术称为超高分辨率的锥形束 CT(CB-CTA)已用于颅内动脉粥样硬化性狭窄的评价。CB-CTA 辐射剂量类似于传统的 CTA,是基于导管方式的有创检查。在评估狭窄上与其他三维方式如 3D 旋转血管造影相比无显著差异 [8]。此外,CB-CTA 与 DSA 相比具有更高的分辨率。根据 DSA 标准,通过 CB-CTA 超过 60% 的患者可发现斑块形态更加详细的信息 [9]。与常规CTA 和 MRA 相比,CB-CTA 评价斑块形态是否有额外的益处,仍需要进一步研究证实。
经颅多普勒超声(TCD)可提供实时血流信息,能检测到微栓子信号,并能提供关于脑自动调节的信息,具有安全、廉价及易于应用于临床操作的优点。不足之处在于临床实践中受限于操作者依赖性和合适的颞骨声窗的要求(在多达20% 的患者中不存在)。研究显示,在 130 例急性缺血性脑卒中患者中,与 DSA 相比,TCD 识别血管狭窄或闭塞的敏感性为 87.5%,特异性为 88.6%,阳性预测值(PPV)为 87.5%,阴性预测值(NPV)为 88.6%[10]。前瞻性卒中结局和颅内动脉粥样硬化神经影像学的(SONIA)试验中,纳入 407 名颅内动脉动脉粥样硬化性狭窄患者 90 天内曾发生 TIA 或卒中,与 DSA 相比,TCD 识别 50~99% 狭窄的 PPV 为 36%,NPV 为 86%,该研究仅仅局限于血管狭窄而排除了血管闭塞,因而 PPV 较低 [11]。经颅彩色编码双超声(TCCS)结合血流速度测量和实质结构,可部分克服这个问题,但仍然需要 DSA的验证。最近的研究显示,使用 TCCS 识别血管狭窄或闭塞的敏感性为 72.9~88.9%,特异性为 82.9~94.8%。PPV 为 51.1~79.4%,NPV 为 77.3~99.3%[12]。然而,由于操作者依赖性高,该技术在临床实践中并不常用。
3D TOF MRA 是一种非侵入性的技术,具有无辐射,不使用造影剂的优点。主要缺点是血液流动引起的伪影。即使血管未完全闭塞,MR 信号也可能完全缺失。在大多数情况下不仅严重狭窄可引起伪影,而且在 <70 的狭窄中也有报道, 这会影响 MRA 的敏感性和特异性。研究比较 TOF-MRA 和CTA 对颅内血管狭窄和闭塞的识别能力,结果显示 ,CTA 优于 TOF-MRA,其敏感性及阳性预测值明显高于 MRA(98%比 70%,93% 比 65%)[13]。CTA 与 MRA 联合识别颅内病变狭窄和闭塞与 DSA 之间的比较也进行了研究,当血管狭窄在 50% 以上时,单独 MRA 的敏感性为 92%,特异性为 91%, CTA 可帮助提高其敏感性和特异性,分别为 100% 和 99%, 并具有预测价值 [14]。研究表明不同成像方式的组合在动脉粥样硬化性狭窄成像上一定程度上能够替代 DSA,需要进一步验证 CTA 和 MRA 在临床实践中联合应用的价值。
随着 MR 技术的进步,迎来了高分辨磁共振血管壁成像(HRMRI),作为传统成像技术的补充,可用于颅内血管壁病变的评估。多项研究表明,HRMRI 识别血管狭窄程度与 DSA 有较好的一致性。HRMRI 具有软组织分辨率高、无骨伪影、三维血管成像、多序列扫描、成像质量好等特点,在血管壁和斑块结果的显示上具有明显的优越性,不仅能定量分析动脉粥样硬化的狭窄程度,还能对斑块进行定性评估,辨别斑块的成分及炎症反应,评价动脉粥样硬化斑块的状态与临床事件的关系 [15]。国外已对颅外颈动脉斑块、冠状动脉斑块的 HRMRI 研究较多,并且获得病理标本的确诊。由颈动脉斑块和冠状动脉斑块的 HRMRI 研究可知,HRMRI 能根据 斑块内的信号特点来推测斑块的成分并判断斑块的稳定性。其中脂质核心和斑块内出血与斑块易损性明显相关。在颈动脉粥样硬化病变中,在 T1加权上,HR MRI 可识别出大的脂质核,为等或稍高信号 ,T2 加权序列为低信号;钙化在所有MRI 序列上显示低信号,斑块内出血在 T1 及 T2 加权序列均为高信号 [16]。HRMRI 另一个突出的优点是能同时显示管壁和管腔,可鉴别不同病因导致的动脉狭窄。在 HRMRI 颅内动脉狭窄研究中,动脉炎性病变多表现为弥漫性动脉管壁增厚伴环形强化 [17];Moyamoya 病表现为大脑中动脉严重狭窄或闭塞,四周有丰富的侧枝循环形成,无管壁增厚及管壁强化[18];典型的动脉夹层表现为双腔征、内膜瓣及壁内血肿 [19];可逆性脑血管收缩综合征主要表现为环形血管壁增厚,无强化或可忽略的轻度强化,随访后上述改变可完全消失 [17]。需要进一步前瞻性研究来确认 HR MRI 在颅内动脉粥样硬化斑块中的应用前景。
3颅内动脉粥样硬化性狭窄的治疗
3.1危险因素控制
高血压、高脂血症、糖尿病和吸烟饮酒是颅内动脉粥样硬化最常见危险因素。一项随机、多中心研究 (PROGRESS) 显示:采用降压治疗,随访 4 年内发现可明显降低卒中风险 [20]。通过积极降低胆固醇水平预防卒中的(SARCL)实验中,随访 4.9 年,与低密度脂蛋白(LDL)胆固醇≥ 2.59mmol/L 相比, LDL<1.81mmol/L 时脑卒中风险可降低 28%[21]。对于 ICAD 危险因素管理的认识开始于 WASID 亚组分析。在 WASID亚组实验中,与平均收缩压<140mmHg 相比,平均收缩压≥ 140mmHg 时,随访 1.8 年发现存在更高的卒中发生率、心肌梗死或血管性死亡率(31%比 18%,P=0.005)。与平均胆固醇 <200mg/dl 相比,总胆固醇≥ 200mg/dl 也与卒中、心肌梗死或血管性死亡的高风险相关。(26% 比 19%,P=0.02)。平均糖化血红蛋白≥ 7% 的患者中有 31% 患者发生卒中、心肌梗死或血管性死亡,而糖化血红蛋白 <7% 时仅有 20%,但在统计学上无显著性差异(P=0.20)[22]。另外生活方式的改变也应纳入管理,如营养均衡、适度锻炼、体重管理,戒烟限酒等。
3.2药物治疗
目前因颅内动脉狭窄引起的缺血性事件主要通过抗血小板药物、改变生活方式及控制血压和血脂。近年来,对症性ICAS 患者选择双重抗血小板治疗增加。与 WASID 试验(应用阿司匹林或华法林)历史对照研究相比,SAMMPRIS 试验中积极的药物管理(即强化危险因素管理联合阿司匹林加氯吡格雷)早期卒中复发率较低 [23]。CLAIR 实验(氯吡格雷联合阿司匹林 VS 阿司匹林单独用于降低急性症状性颅内或颈动脉狭窄引起的栓塞)可进一步支持双重抗血小板治疗,试验表明,与单独服用阿司匹林相比,联合阿司匹林和氯吡格雷可降低经颅多普勒超声微栓子信号的数量(31% 比 54%)[24]。
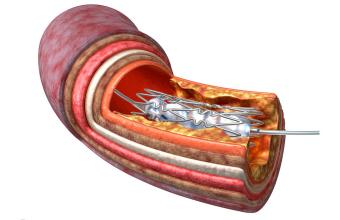
3.3支架治疗
SAMMPRIS 试验表明,颅内动脉狭窄在 70%~99% 的患者出现 TIA 或脑卒中时,积极的药物管理比经皮血管腔内成形术和支架置入术后联合积极的药物管理具有更大的益处 [23]。与症状性颅内动脉狭窄患者积极药物治疗相比,颅内支架置入术与复发性缺血性事件或死亡风险增加有关(15% VS 6% 在 30 天的随访;23% VS 15% 在 32 个月的随访)。在 VISSIT(颅内支架治疗缺血性卒中)试验中,与症状性颅内动脉粥样硬化性狭窄患者药物治疗相比,相同支架置入术后的不良结果也显示出不同(如球囊扩张)(24% VS 9% 在 30天的随访,36% VS 15% 在 12 个月随访)[6]。尽管颅内支架在 VISSIT 和 SAMMPRIS 中的表现令人失望,有研究显示, 高危亚组患者对药物治疗无反应时,可能会受益于支架治疗。严重颅内动脉粥样硬化性狭窄及影像学显示血流动力学障碍的患者颅内支架置入复发性卒中或 TIA 的发生率较低(4%,随访 30 天),成功率较高(97%)[4]。HRMRI 血管壁的发现有助于患者选择和支架选择。目前在一项大型的中国研究中,纳入低灌注所致卒中患者,基于动脉走行和病变形态,在迂曲动脉走行患者中优先使用自膨胀支架,而在平直血管走行患者中优选球囊可扩张支架 [25]。
3.4其他治疗
在 EC-IC(颅外 - 颅内)旁路试验中,与单纯内科药物治疗相比,颅内狭窄病变患者直接血运重建术的预后较差。超过 700 名颅内动脉粥样硬化性狭窄患者被随机分配到最佳的医疗中心进行搭桥手术连接颞浅动脉和大脑中动脉。平均随访 56 个月后,没有明显证据表明手术减少了卒中复发率。18% 的内科治疗组和 20% 的手术治疗组曾出现一次复发性卒中。两次或多次复发性卒中发生在 10% 的内科治疗组和11% 的手术治疗组 [26]。症状性颅内动脉粥样硬化性狭窄新疗法看起来是有前景的,包括远端肢体缺血调节(涉及肢体出现重复性、短暂性非损伤性缺血,导致循环介质释放可增加脑血流和称为脑动脉 - 硬脑膜动脉(EDAS)的间接血运重建手术)[27]。最近发表的一项研究中,症状性颅内动脉粥样硬化狭窄患者尽管已首选药物治疗,当出现与血管狭窄区域相关的短暂性脑缺血发作或非致残性卒中时,将进行间接血运重建术。基本原理在于,无症状性颅内动脉粥样硬化狭窄患者可有充分的脑膜侧支,而症状性颅内动脉粥样硬化狭窄患者可通过间接血运重建后获益。研究发现,仅包含低灌注和侧支血流不良颅内动脉粥样硬化性狭窄的患者,通过 EDAS 治疗, 平均随访 2 年,复发性缺血性事件发生率明显降低(5.6%)[28]。
4总结
颅内动脉粥样硬化性疾病是卒中非常普遍的病因。积极的药物治疗和危险因素的控制是目前治疗的最佳选择。然而也需要进一步研究评估症状性和复发性卒中患者积极的药物治疗失败后更优化的治疗方式。明确颅内动脉粥样硬化的卒中机制,有助于高危亚组患者识别,能更好的受益于积极的治疗。与此同时,新的成像技术,如高分辨率 MR 技术很有可能成为最有前景的技术来实现颅内动脉粥样硬化性改变的详细评估。
参考文献:
[1]Qureshi AI, Caplan LR.Intracranial atherosclerosis[J]. Lancet, 2014,383:984-998.
[2]Jung JM, Kang DW, Yu KH, et al. TOSS-2 Investigators: Predictors of recurrent stroke in patients with symptomatic intracranial arterial stenosis[J]. Stroke,2013,43(10):2785-2787.
[3]López-Cancio E, Matheus MG, Romano JG, et al. Infarct patterns, collaterals and likely causative mechanisms of stroke in symptomatic intracranial atherosclerosis[J]. Cerebrovasc Dis, 2014,37(6):417-22.
[4]Miao Z, Zhang Y, Shuai J, et al. Thirty- Day Outcome of a Multicenter Registry Study of Stenting for Symptomatic Intracranial Artery Stenosis in China[J]. Stroke,2015,46(10):2822-2829.
[5]Chimowitz MI, Lynn MJ, Derdeyn CP, et al. Stenting versus aggressive medical therapy for intracranial arterial stenosis[J]. The New England Journal of Medicine,,2011,365(11):993-1003.
[6]Zaidat OO, Fitzsimmons BF, Woodward BK,et al.Effect of a balloon- expandable intracranial stent vs medical therapy on risk of stroke in patients with symptomatic intracranial stenosis: the VISSIT randomized clinical trial[J]. JAMA, 2015,313(12):1240-1248.
[7]Liebeskind DS, Kosinski AS, Saver JL,et al. Computed Tomography Angiography in the Stroke Outcomes and Neuro-imaging of Intracranial Atherosclerosis (SONIA) Study[J]. Interventional Neuroradiology, 2014,2(29):153-159.
[8]Safain M G, Rahal JP, Patel S, et al.Superior performance of cone- beam CT angiography in characterization of intracranial atherosclerosis[J]. Journal of Neurosurgery, 2014,121(2):441-449.
[9]Damaskos S, Aartman IH, Tsiklakis K,et al.Association between extra- and intracranial calcifications of the internal carotid artery: a Cone Beam CT imaging study[J]. Dentomaxillofac Radiology, 2015,44(5):201-204.
[10]Topcuoglu MA.Transcranial Doppler ultrasound in neurovascular diseases: diagnostic and therapeutic aspects[J]. Journal of Neurochemist ry,2012,123(2):39-51.
[11]Feldmann E, Wilterdink JL, Kosinski A, et al. The Stroke Outcomes and Neuroimaging of Intracranial Atherosclerosis (SONIA) trial[J]. Neurology,2007, 68(24):2099-2106.
[12]Roubec M, Kuliha M, Jonszta T, et al. Detection of intracranial arterial stenosis using transcranial color- coded duplex sonography, computed tomographic angiography, and digital subtraction angiography[J]. Journal of Ultrasound in Medicine, 2011,30:1069-1075.
[13]Bash S, Villablanca JP, Jahan R, et al. Intracranial vascular stenosis and occlusive disease: evaluation with CT angiography, MR angiography, and digital subtrac-tion angiography[J]. AJNR,2005,26(5):1012-1021.
[14]Hirai T, Korogi Y, Ono K, et al. Prospective evaluation of suspected stenoocclusive disease of the intracranial artery: combined MR angiography and CT angiography compared with digital subtraction angiography[J]. AJNR,2002,23(1):93-101.
[15]Nighoghossian N,Derex L,Douek P.The vulnerable carotid artery plaque:current imaging methods and new perspectives[J]. Stroke,2015,36(12):2764-2772.
[16]Chung JW, Kim BJ, Choi BS, et al. High resolution magnetic resonance imaging reveals hidden etiologies of symptomatic vertebral arterial lesions[J]. Stroke,2014,23(2):299-302.
[17]Obusez EC, Hui F, Hajj-Ali RA, et al. High-resolution MRI vessel wall imaging: spatial and temporal patterns of reversible cerebral vasoconstriction syndrome and central nervous system vasculitis[J]. AJNR Am J Neuroradi ol,2014,35(8):1527-1532.
[18]Ryoos, Cha J, KimSJ, et al. High-resolution magnetic resonance wall imaging findings of Moyamoya disease[J]. Stroke,2014,45(8):245-260.
[19]Choi YJ, Jung SC, Lee DH. Vessel Wall Imaging of the Intracranial and Cervical Carotid Arteries[J]. J stroke,2015,17(3):238-255.
[20]PROGRESS Collaborative Group. Randomised trial of a perindopril-based blood-pressure-lowering regimen among 6105 individuals with previous stroke or transient ischaemic attack[J]. Lancet,2001,358:1033-1041.
[21]Amarenco P, Bogousslavsky J, Callahan A 3rd,et al. Stroke Prevention by Aggressive Reduction in Cholesterol Levels (SPARCL) Investigators. High- dose atorvastatin after stroke or transient ischemic attack[J]. N Engl J Med,2006, 355(20):545-559.
[22]Chaturvedi S, Turan TN, Lynn MJ, et al. WASID Study Group. Risk factor status and vascular events in patients with symptomatic intracranial stenosis[J]. Neurology,2007, 69:2063-2068.
[23]Derdeyn CP, Chimowitz MI, Lynn MJ, etal. Aggressive medical treatment with or without stenting in high- risk patients with intracranial artery stenosis (SAMMPRIS): the final results of a randomised trial[J]. Lancet,2014,383(9914):333-341.
[24]Turan TN, Cotsonis G, Lynn MJ, et al.Intracranial stenosis: impact of randomized trials on treatment preferences of US neurologists and neurointer-ventionists[J]. Cerebrovascular Diseases,2014,37(3),203-211.
[25]Wang Y, Zhao X, Liu L, et al. Prevalence and outcomes of symptomatic intracranial large artery ste-noses and occlusions in China: the Chinese Intracranial Atherosclerosis (CICAS) Study[J]. Stroke, 2014, 45(3):663-669.
[26]The EC/IC Bypass Study Group. Failure of extracranial-intracranial arterial bypass to reduce the risk of ischemic stroke. Results of an international randomized trial[J]. N Engl J Med,1985,313(3):1191-200.
[27]Chimowitz MI, Derdeyn, CP. Endovascular therapy for atherosclerotic intracranial arterial stenosis:back to the drawing board[J]. Journal of the American Medical Association,2015,313(12):1219-1220.
Gonzalez NR,Dusick JR,Connolly M, et al.Encephaloduroarteriosynangiosis for adult intracranial arterial steno- [28]occlusive disease:long-term single-center experience with 107 operations[J]. Journal of Neurosurgery,2015,123(3):1-8.
《颅内动脉粥样硬化性狭窄的成像方式和治疗现状论文》附论文PDF版下载:
http://www.lunwensci.com/uploadfile/2018/1217/20181217042001719.pdf
关注SCI论文创作发表,寻求SCI论文修改润色、SCI论文代发表等服务支撑,请锁定SCI论文网!
文章出自SCI论文网转载请注明出处:https://www.lunwensci.com/yixuelunwen/2253.html