SCI论文(www.lunwensci.com):
摘要:目的对猪源牛病毒性腹泻病毒荧光RT-PCR方法的建立与监测进行分析。方法对屠宰场的359份屠宰猪血清进行牛病毒性腹泻病毒(以下简称为BVDV)感染的病原进行检测。结果待检测的359份血清样品中有52分成阳性,阳性率为14.5%,其中发现13份BVDV阳性样品中5′端UTR片段均与VEDEVAC进化谱系较为密切,均为基因Ⅰ型。结论猪源BVDV建立特异性荧光RT-PCR方法于对猪源BVDV感染的监测具有良好的特异性和重复性,有良好的应用价值。
关键词:猪源牛病毒性腹泻病毒;荧光RT-PCR方法;建立;监测
本文引用格式:王梦迪.检测猪源牛病毒性腹泻病毒荧光RT-PCR方法的建立与监测分析[J].世界最新医学信息文摘,2019,19(82):240,243.
0引言
在中国,王新平于1996年首次发现该病毒,并从疑似猪瘟病例中检测分离出来。目前,吉林、辽宁、浙江、上海和福建的猪都感染了BVDV。感染BVDV的猪不仅区分临床症状而且仅与软猪瘟病感染类似的临床症状和病理变化,因此BVDV可区别于猪瘟病毒感染和区别BVDV和猪瘟病毒症状。在免疫学方面,疾病和猪瘟也存在广泛的交叉性,很难诊断并预防。研究提出了猪荧光RT-PCR检测BVDV的方法,为上述福州屠宰猪BVDV病原体检测猪BVDV来源的研究奠定了基础。
1材料与方法
1.1细胞和病毒
参考菌株小病毒腹泻病毒(BVDV)OreGOnC24V、猪株(HCLv)CH-1 R、猪繁殖与呼吸综合征(PRRSV)、便携式猪胃肠炎病毒(TGEV)HB08由阻尼公司有限公司提供;小肾细胞传代细胞(mDBK)由天津进入检验检疫局提供。
1.2主要试剂和仪器
Mem营养液在GiBCO购买;裂解物TrizOL购自inViTrOGen;Taq DNA聚合酶;从AMV逆转录酶RNA抑制DnTPmiXTure Vao Biology(Dalian)Co;在BiOrAD购买的CFX96定量PCR荧光仪器。
1.3检测样品来源
从屠宰场福州附近的屠宰猪采集的35.9个样本测试。
1.4样品处理与病毒RNA提取
1.4.1样品处理
从5mL预冷的PBS靶均匀的输入中取出上清液,将2mL屠宰的猪血清在10℃下混合离心至少10分钟,然后使用500r。
1.4.2参考病毒悬液和毒力测定
通常用mDBK细胞培养BVDV参考菌株OreGOnC24V,将病毒解冻,洗涤3次并以5000rpm离心10分钟。将上清液储存在-70℃用作参考病毒悬浮液。将参考病毒悬浮液用维持溶液中稀释10-1至10-8倍,并将每滴度5.0l/孔加入96孔细胞培养板的4个孔中。将稳定良好的单层细胞,溶解在细胞的分散液中,然后通过生长溶液以每孔100l的3×105细胞毒性缓冲液·mL&supmin加入到细胞板的每个孔中来制备。同时,在每个平板上设置4孔细胞对照。在37℃和6℃下观察培养物,记录二氧化碳培养和细胞损伤。使用Reed-muenCH方法计算感染物的一半(TCiD 5.0/5.0l)。
1.5荧光RT-PCR扩增
1.5.1敏感性试验
除去标准病毒悬浮液,在荧光RT-PCR反应系统和1.4.1中描述的方法中,在尽可能相同的条件下稀释和扩增1.0倍稀释的病毒总RNA,确保灵敏度。
1.5.2重复性试验
在相同条件下测试BVDV参考病毒悬浮液的单个样品五次,以确定组内的重复性,并且重复单个样品重复五次以重复RNA确定检测到的组。
1.5.3荧光RT-PCR的应用检测
使用建立的RT-PCR荧光法测试屠宰的猪血清样品。
2结果与分析
2.1荧光RT-PCR敏感性试验结果
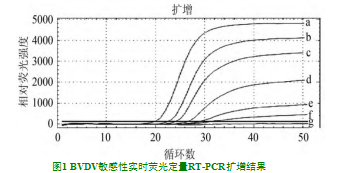
根据病毒悬浮液的毒力试验结果,通过Reed-Muignton法用105.2 TCiD 50/50l计算一半的感染剂量,并将病毒的毒力稀释10倍。通过荧光RT-PCR提取的104、105、106、107,、108、109.1×102.21×101.2、1×100.2、1×10-8、1×10-1.8、1×102.8、1×10-3.8 TCiD 50/50l稀释病毒RNA检测到结果,该方法的最小检测限为1×10-2.8 TCiD 50/50L。结果如图1所示。
2.2荧光RT-PCR特异性试验结果
如果使用与BVDV参考菌株相同的引物和探针来检测荧光RT-PCR显示正常的扩增曲线,而MDBK细胞、PRRS菌株、TGEV菌株和HCLv菌株没有更多的扩增曲线,对BVDV参考病毒样品进行5次荧光RT-PCR实验。荧光RT-PCR的重复性2.4结果在相同条件下复制,获得相同的扩增曲线,从而显示组内的重复性。用RNA提取单个样品5次以重复RT-PCR检测,并获得所得的扩增曲线。结果表明,该方法具有良好的组间重复性。
2.3荧光RT-PCR的应用检测
基于现有的荧光RT-PCR,在52只BVDV阳性血清中发现的359只屠宰猪的血液中,BVDV的量为14.5%。这表明福州附近的屠宰猪感染了BVDV,并检测到了猪的BVDV。
2.4临床应用
来自95个临床样本的13个BVDV阳性样本是RT-PCR,12个BVDV样本(阳性率14.1%),1个猪瘟疫苗,FQ-PCR结果,13个阳性标本和RT-PCR结果一致。使用语音RT-PCR在猪样品中检测到两个新的阳性样品。猪的患病率为16.5%(14/85)。BVDV阳性样品与RT-PCR相同,两种方法的共识率为86.7%。试验结果表明,建立的FQ-PCR方法检测临床猪病和猪瘟疫苗的结果准确可靠,推广价值高。
3讨论与结论
由于小病毒性腹泻病毒(BVDV)和BVDV的诊断表明,典型猪瘟病毒(CSFV)之间的大规模抗原结合是困难的,并且与常规方法相比,荧光RT-PCR的方法是更先进的检测方法而且具有明显的益处。福州市周围359头屠宰猪血清样本结果表明,小型腹泻病毒OreGOnC24V的标准菌株和荧光RT-PCR检测猪BVDV的方法具有良好的特异性和重复性。发现13个BVDV阳性样品的5'-末端-UTR片段的序列分析与VEDEVAC进化密切相关,它们均由现有荧光RT-PCR猪的基因分型显示。程序BVDV适用于监测猪的BVDV感染,通过荧光RT-PCR从359个猪血清样品中检测到52个BVDV阳性样品,以检测猪的BVDV。BVDV感染率略高于福建猪14.5%,样本阳性BVDV感染率为8.1%,福州地区猪BVDV抗体阳性率为34.7%,福州地区猪和屠宰猪的BVDV感染率为34.7%。王新平(1996)首次在中国报道了感染BVDV的猪,包括福建、河南、浙江、安徽、湖南、江西、广西和辽宁省的猪BVDV感染。这种BVDV感染也可能适用于猪群,这可能对猪造成严重影响。BVDV感染后的猪引起临床症状和病理变化,如慢性猪瘟。猪群中的BVDV感染可导致生殖障碍,窝产仔数减少和遗传病。仔猪先天性感染不仅会产生持续感染和免疫耐受的BVDV抗体,而且还会产生BVDV对感染母猪的产后BVDV交叉反应,猪瘟病毒的长期毒性可以转移。BVDV还会降低猪瘟疫苗的免疫效果。来自猪群的BVDV感染难以预防和控制BVD,BVDV感染发生在中国的几个猪群中,并引起临床症状和病理变化,例如慢性猪瘟,并且已知会导致养猪业的经济损失。因此,它在相关部门得到高度重视。
参考文献
[1]梁洪,王怀禹,粟元文,等.猪源牛病毒性腹泻病毒的分离与鉴定[J].黑龙江畜牧兽医,2019,(10):90-92+178.
[2]王应龙,徐尚荣,张学忠,等.藏羊源牛病毒性腹泻病毒的分离鉴定及生物学特性分析[J].黑龙江畜牧兽医,2019,(07):87-90+170.
关注SCI论文创作发表,寻求SCI论文修改润色、SCI论文代发表等服务支撑,请锁定SCI论文网! 文章出自SCI论文网转载请注明出处:https://www.lunwensci.com/yixuelunwen/14955.html