SCI论文(www.lunwensci.com):
摘要:2型糖尿病是临床较为常见的慢性疾病,胰岛素抵抗是2型糖尿病的一个重要发病机制,在其发展的整个过程中均发挥作用。本文就胰岛素信号转导通路,以及细胞水平、分子转导水平和机体多种代谢产物水平对胰岛素抵抗的发生机制做一扼要概述。
关键词:胰岛素信号通路;胰岛素抵抗;信号转导
本文引用格式:孙志梅,齐亚娟.胰岛素信号通路与胰岛素抵抗[J].世界最新医学信息文摘,2019,19(52):62-63.
Insulin Signaling Pathway and Insulin ResistanceSUN Zhi-mei,QI Ya-juanHebei Key Laboratory for Chronic Diseases,Tangshan Key Laboratory for Preclinical and Basic Research on Chronic Diseases,School of Basic Medi-cal Sciences,North China University of Science and Technology,Tangshan Hebei)
ABSTRACT:Type 2 diabetes mellitus is a common chronic diabetic in clinic.Insulin resistance is an important pathogenesis of type 2 diabetes mellitus,it plays a role in the whole process of its development.This article briefly summarizes the insulin signal transduction pathway,and cell level,molecular transduction level and metabolite level of insulin resistance.
KEY WORDS:Insulin signaling pathway;Insulin resistance;Signal transduction
0引言
糖尿病是最常见的慢性疾病。据统计,2017年全球约有4.51亿人患有糖尿病,成人糖尿病患病率高达8.4%。预计到2045年达到9.9%[1]。糖尿病主要有两种类型:1型糖尿病(胰岛素依赖型),其发病机制主要由胰岛β-细胞功能衰竭、胰岛素分泌绝对不足而致;而2型糖尿病(非胰岛素依赖型),是胰岛素相对不足与胰岛素抵抗(insulin resistance,IR),其中,2型糖尿病(Type 2 diabetes mel-litus,T2DM)占比高达90%以上[2],IR是T2DM的一个重要发病机制,是指各种原因使胰岛素在其靶器官,如肝脏,脂肪,肌肉,胰腺和脑等,促进葡萄糖摄取和利用的效率下降,导致血糖升高,机体代偿性的分泌过多胰岛素产生高胰岛素血症,以维持血糖的稳定。
1胰岛素与胰岛素信号通路
1.1胰岛素作用
目前胰岛素是体内降糖的惟一一种蛋白质激素。胰岛素在其靶器官调控代谢和生长,包括刺激糖原合成,抑制胰高血糖素的作用和肝脏的糖异生,促进脂质生成、基因转录和翻译。胰岛素由胰岛β细胞分泌,通过血液循环带到靶器官,在靶组织细胞上调葡萄糖转运体蛋白的表达和移位到细胞膜,提高机体对葡萄糖的利用,从而降低血糖。在食用富含碳水化合物的饮食后,葡萄糖主要以糖原的形式储存在肌肉和肝脏中[3,4]。胰岛素在靶器官中的作用降低会导致空腹和餐后高血糖症[7,8]和出现T2DM以及是长期微血管(视网膜病变、肾病和神经病)和大血管(心血管疾病)并发症的主要危险因素[5]。
1.2胰岛素信号通路
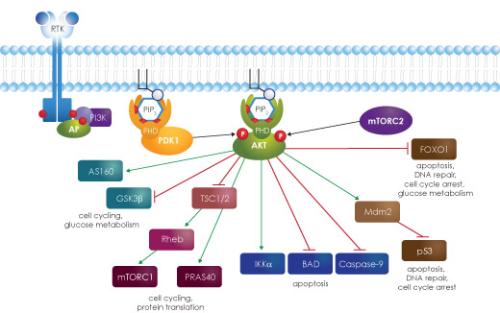
胰岛素在细胞内主要激活两条信号通路:丝裂原激活蛋白激酶(Mitogen-activated protein kinases,MAPKs)和3-磷酸肌醇激酶(Phosphotidylinositide-3-kinase,PI3K)通路,而控制细胞生长,代谢和存活。胰岛素与靶组织细胞膜上的胰岛素受体相结合是胰岛素信号通路激活的第一步。胰岛素受体由α、β两个亚单位组成:α亚单位是细胞内结构域,β亚单位是跨膜结构域,其胞内含酪氨酸蛋白激酶位点。胰岛素与其受体α亚单位结合后,导致β亚单位反式自磷酸化,β亚单位上酪氨酸激酶被激活,从而磷酸化细胞内的多种蛋白质,如胰岛素受体底物(insulin receptor substrate,IRSs)。
其中IRSs作为一种船坞蛋白,可以结合带SH2结构域的蛋白。PI3K能被G蛋白偶联受体或者受体酪氨酸激酶激活,被激活的PI3K磷酸化PIP2后产生PIP3,PIP3作为细胞内的第二信激活PDK1和PDK2[6],然后募集Akt(PKB)到细胞膜上,使Akt磷酸化并使其蛋白激酶活性被激活[1]。
Akt磷酸化许多下游信号分子,包括磷酸化糖原合酶激酶(glycogen synthase kinase,GSK)-3β,并导致葡萄糖转运体-2(glucose transporter,GLUT-2)和GLUT-4从胞质溶胶转移到质膜,促进细胞葡萄糖摄取,抑制糖原合成,从而达到降低血糖的目的[8]。
Akt进而还可磷酸化细胞核转录因子Foxo1的S256位点,诱导Foxo1蛋白质的降解,进而抑制Foxo1调控的基因表达[9]。滞留在核内的Foxo1作为内源性转录因子,可活化肝脏糖异生反应限速酶—磷酸烯醇式丙酮酸羧基激酶和葡萄糖-6-磷酸酶基因表达,进而促进肝脏糖异生反应合成葡萄糖的能力[10]。
2胰岛素抵抗
IR是指正常剂量的胰岛素作用于机体后产生的生物学效应低于预期水平,常伴随高胰岛素血症[11]。当营养物质的供给和需求失衡,IR就会产生,胰岛素抵抗存在于多种组织中,包括骨骼肌、肝脏、脂肪组织、肾脏、胃肠道、血管系统和大脑。肌肉IR表现为摄入富含碳水化合物的膳食后葡萄糖摄取受损,并导致餐后高血糖症[12],可能是因为胰岛素刺激的葡萄糖转运减少导致胰岛素刺激的肌肉糖原合成也减少[13]。肝IR的特征是胰岛素在餐后条件下不能刺激肝糖原合成和抑制了肝葡萄糖生成。
在IR患者中,由于肝糖异生的增加,肝葡萄糖生成增加导致了空腹和餐后高血糖症。总的来说,这些组织中胰岛素生物活性的改变对胰岛-β细胞施加压力,以增加胰岛素分泌,试图抵消胰岛素作用的缺陷,这时会导致高胰岛素血症。然而,随着疾病的发展,β-细胞开始衰竭,随后出现一个恶性循环,包括葡萄糖和脂肪毒性,以及可能的β-细胞以外的因素,导致胰岛素分泌进一步下降、高血糖恶化[4]。IR发生机制复杂,是多种因素相互作用、相互影响的结果,可发生在细胞水平、分子水平及多种机体代谢产物上。
2.1细胞水平胰岛素抵抗
胰岛素靶器官细胞,如肝细胞、肌细胞、脂肪细胞对胰岛素的敏感性下降,细胞对葡萄糖摄取、利用和糖原合成能力下降,同时产生的葡糖糖增多,最终导致空腹血糖和餐后血糖升高。
2.2分子水平胰岛素抵抗
分子水平IR是胰岛素在细胞内的信号转导通路发生改变,可在不同水平发生。(1)受体前IR:①胰岛素基因突变改变其结构。②胰岛素发生降解。③胰岛素拮抗素增多。④无胰岛素受体或受体减少无法结合。(2)受体IR:α、β两个亚单位数目、亲和力下降。(3)受体后IR:①胰岛素受体底物(IRS)异常,IRS降解、磷酸化及分布异常,表现在IRS含量减少,或酪氨酸磷酸化位点减少,等引起IR。许多诱发IR的因子都是通过IRSs蛋白激酶来影响胰岛素信号转导的。在T2DM患者中,IRS蛋白的表达水平降低。
②PI3K异常,PI3K活化受阻和表达异常也会阻断胰岛素信号通路,而导致IR。③PKD与AKT异常:作为PI3K的靶分子PKD和Akt出现异常,也会导致IR的发生。④GSK-3异常:胰岛素作用于GSK-3被磷酸化而失活,糖原合成开始,葡萄糖转运增加,GSK-3增多与IR关系密切。⑤葡萄糖转运体异常,葡萄糖转运体减少及活性障碍都会使增加葡萄糖的摄取利用难度增加,引起胰岛素功能障碍[15]。⑥最近研究表明,激活Foxo1转录因子是胰岛素抵抗发生的重要细胞学和生理学机制[14]。
2.3机体代谢物质导致胰岛素抵抗
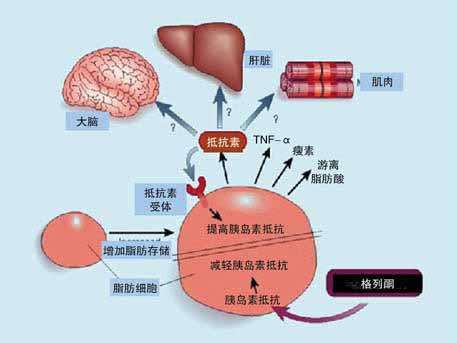
FFA导致IR。在1998年证实血清游离脂肪酸(free fatty acid,FFA)升高经过骨骼肌细胞导致外周胰岛素抵抗,从而开启FFA致胰岛功能受损的胰岛素抵抗研究。脂肪细胞分泌过量的FFA。FFA作用于胰岛细胞后呈现出双向靶向关系,FFA是胰岛细胞获取能量的一大来源,和葡萄糖相互作用增加胰岛素输出,但是胰岛细胞长时间处于脂肪酸作用下,过多的脂肪酸阻碍并减少胰岛-β细胞泌出胰岛素,引起胰岛-β细胞死亡的不良结局,这就是临床上的脂毒性说法[16]。
FFA能够抑止糖氧化,在FFA作用下产生超长量的自由基引起氧化应激;FFA通过增加糖异生,降低葡萄糖摄取的同时输出变多了,引起IR;FFA介导G蛋白偶联受体的脂毒性过程,不仅发生IR使高胰岛素血症也出现;FFA能够降低IRSs生物效应,阻断胰岛素作用受体,阻断了信号传递途径,结果是多余的FFA被转运失败,引起IR的发生[17]。
低血浆脂联素导致IR。
脂肪组织分泌的脂联素是特殊蛋白质,能够产生抗糖尿病的效果。脂联素储存于脂肪组织。正常状态下,健康人血浆内脂联素含量要高于糖尿病患者,脂联素含量的上调与T2DM患病率呈正相关。脂联素介导FFA氧化应激功能,提高对胰岛素的敏感性。
低血浆瘦素导致IR。脂肪组织产生的瘦素,不仅可以通过神经系统控制饮食产生的诱惑,还可以加快能量的运输[18]。脂肪组织不能输出瘦素或者输出量低微的情况下,外周组织—肌肉、脑等—积累过多的脂肪,胰岛素输出被改变,外源性瘦素增多能降低FFA的产量,增强胰岛素作用于身体组织的灵敏度[19]。
TNF-ɑ增多导致IR。巨噬细胞被激活分泌泌肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α),其生物效应很多。肝脏组织库普弗细胞能够分泌TNF-ɑ。TNF-ɑ与炎症反应密切相关。库普弗细胞还能分泌IL-6和IL-8以及内皮素等细胞因子,TNF-ɑ只限于肝病中发挥作用,不参与其他组织病变。肝脏出现炎症TNF-ɑ含量就会变多,在T2DM发病中也是一样变多。TNF-α能增加FFA的分泌,通过胰岛素信号通路降低GLUT-2和GLUT-4活性,降低葡萄糖的吸取,增加血液中葡萄糖含量导致高胰岛素血症的发生。TNF-α还可以和瘦素产生协同作用,导致糖异生,还可阻断IRS磷酸化过程,这些都能导致IR发生[20]。
拮抗素导致IR:拮抗胰岛素功能的激素叫做拮抗素,导致IR机制如下拮抗素阻断胰岛素信号通路,主要表现在对IRS产生影响,PI3K和Akt被磷酸化中断,引起IR。拮抗素和FFA发挥协同作用导致IR。
血清胰岛素样生长因子-1(IGF-1)和胰岛素样生长因子结合蛋白-1(IGFBP-1)诱导IR:IGF-1与IGFBP-1由肝脏分泌的。肝脏疾病发生时IGF-1、IGFBP-1也相应发生了变化,即增加了IGFBP-1含量的同时减少了IGF-1。IGF-1有一半的组成成分跟胰岛素相似,这种一致性使IGF-1胰岛素样活性,二者共同抢占受体。IGF-1与胰岛素含量呈负相关,IGF-1含量减少相应的胰岛素会变多,这时高胰岛素血症出现和IR[21]。
3总结
近年来,T2DM的发病率逐年上升,IR又是T2DM重要发病机制,深入理解胰岛素信号通路,及IR的机制是十分必要的,有助于T2DM的早期诊断、干预和预后,为临床治疗糖尿病提供一个新视角。
参考文献
[1]Cho N H,Shaw J E,Karuranga S,et al.IDF Diabetes Atlas:Global estimates of diabetes prevalence for 2017 and projections for 2045[J].Diabetes Research and Clinical Practice,2018,138:271-281.
[2]Ahmadieh H,Azar S T.Liver disease and diabetes:association,pathophysiology,and management[J].Diabetes Research and Clinical Practice,2014,(1):53-62.
[3]赵连卿.饮食护理干预对糖尿病血糖控制的影响探讨[J].基层医学论坛,2017,(12):1503-1504..
[4]张倩,张永莉,逯明福,等.代餐饮食主导的生活方式管理对2型糖尿病患者的影响[J].中国慢性病预防与控制,2019,27(1).
[5]Nazimek-Siewniak B,Moczulski D,Grzeszczak W.Risk of macrovascular and microvascular complications in Type 2 diabetes:Results of longitudinal study design[J].Journal of Diabetes and its Complications,2002,16(4):271-276.
[6]杨运华.胰岛素抵抗对肝胰岛素PI3K/Akt/GSK-3信号传导通路的影响[J].黔南民族医专学报,2013,(2):79-81.
[7]Richard M,Bradley E.Akt/PKB activation and insulin signaling:a novel insulin signaling pathway in the treatment of type 2 diabetes[J].Diabetes,Metabolic Syndrome and Obesity:Targets and Therapy,2014,(7):55-64.
[8]Jiménez-Osorio AS,Monroy A,Alavez S.Curcumin and insulin resistance-Molecular targets and clinical evidences[J].Biofactors,2016,42(6):561.
[9]Guo S.Insulin signaling,resistance,and the metabolic syndrome:Insights from mouse models into disease mechanisms[J].J Endocrinol,2014,(1):1-23.
[10]Zhang K,Li L,Qi Y,Zhu X,Gan B,DePinho RA,Averitt T,Guo S.Hepatic suppression of foxo1 and foxo3 causes hypoglycemia and hyperlipidemia in mice[J].Endocrinology,2012,(2):631-646.
[11]杨毕,童宗武,卢永新.慢性肾脏病患者胰岛素抵抗的研究进展[J].临床荟萃,2018,(9):821-824.
[12]宋桉,宋光耀.寻找适合中国2型糖尿病患者的理想胰岛素治疗方案——高比例预混胰岛素类似物的研究进展与临床应用[J].中国糖尿病杂志,2017,(3):285-288.
[13]None.Ectopic Fat in Insulin Resistance,Dyslipidemia,and Cardiometabolic Disease[J].New England Journal of Medicine,2014,371(23):2236-2238.
[14]Leigh J,Rachel J P,Gerald I S.Emerging Pharmacological Targets for the Treatment of Nonalcoholic Fatty Liver Disease,Insulin Resistance,and Type 2 Diabetes[J].Annual Review of Pharmacology Toxicology,2019,59:65-87
[15]Park J E,Park J Y,Seo Y,et al.A new chromanone isolated from Portulaca oleracea L.increases glucose uptake by stimulating GLUT4 translocation to the plasma membrane in 3T3-L1 adipocytes[J].Int J Biol Macromol,2019,123:26-34.
[16]胡彩虹,王文修,张涛,等.2型糖尿病患者血清中游离脂肪酸与血糖及胰岛素抵抗关系的探讨[J].中国卫生检验杂志,2016,(9):1288-1290.
[17]易建,万幼云,肖璟,等.2型糖尿病患者血清β-arrestin2、RBP4、FFA水平变化及其与胰岛素抵抗的关系[J].山东医药,2018,(20):75-77.
[18]李静芳,付艳芹,张苏河.瘦素、脂代谢紊乱与妊娠期糖尿病的关系[J].实用医学杂志,2016,(19):3130-3132.
[19]Kayacetin E,Kisakol G,Gonen S,et al.Alterations of Serum Leptin Levels in Patients With Nonalcoholic Liver Cirrhosis[J].The Endocrinologist,2006,16(2):61-63.
[20]徐海波,闫晓光,钟威.新诊断2型糖尿病患者血清Nesfatin-1、肿瘤坏死因子-α水平与胰岛素抵抗的相关性研究[J].中国糖尿病杂志,2017,(1):45-48.
[21]李敏,孔丽凤.分析2型糖尿病合并非酒精性脂肪性肝病患者IGF-1与胰岛素抵抗关系[J].中国保健营养,2016,(3):273.
关注SCI论文创作发表,寻求SCI论文修改润色、SCI论文代发表等服务支撑,请锁定SCI论文网!
文章出自SCI论文网转载请注明出处:https://www.lunwensci.com/yixuelunwen/11766.html