SCI论文(www.lunwensci.com):
摘要:功能性消化不良(functional dyspepsia,FD)是消化内科常见病症,但其确切发病机制尚未完全阐明,目前普遍认为与胃肠动力、内脏敏感性、精神心理、肠道免疫与微生态等多种因素有关。近年来随着对FD的深入研究,众多学者认为脑-肠轴在FD的发病中起着重要作用,本文旨在通过以上几方面对脑-肠轴与FD的相关性做一综述。
关键词:功能性消化不良;发病机制;脑-肠轴
本文引用格式:宋圆圆,李晓丽.脑-肠轴与功能性消化不良相关性的研究进展[J].世界最新医学信息文摘,2019,19(52):64-65.
Research Progress on the Correlation between Brain-gut Axis and Functional Dyspepsia
SOGN Yuan-yuan1,LI Xiao-li2(1.Shanxi Medical University,Taiyuan City,Taiyuan Shanxi;2.Department of Gastroenterology,the First Clinical Hospital of Shanxi Medical University,Taiyuan City,Taiyuan Shanxi)
ABSTRACT:Functional dyspepsia(FD)is a common disease in gastroenterology,but its exact pathogenesis has not been fully elucidated.Currently,it is generally believed to be related to gastrointestinal motility,visceral sensitivity,mental state,intestinal immunity,microecology and other factors.In recent years,with the in-depth study of FD,many scholars believe that brain-gut axis plays an important role in the pathogenesis of FD.This paper aims to summarize the correlation between brain-gut axis and FD from the above aspects.
KEY WORDS:Functional dyspepsia;Brain-gut axis;Pathogenesis
0引言
功能性消化不良(functional dyspepsia,FD)是具有上腹痛、上腹烧灼感、早饱、餐后饱胀等慢性消化不良症状,但不能用器质性、系统性或代谢性疾病等来解释症状产生原因的疾病[1-2]。西方国家人群中,FD发病率约为10%~30%,我国消化不良患者约占普通内科门诊的10%,占消化科门诊的50%[3-4],但确切机制尚未完全阐明,罗马委员会认为FD是一种脑-肠相互作用的疾病[5-6]。本文就脑-肠轴与FD的相关性做一综述,以期为FD发病机制的研究及治疗方案的选择提供帮助。
1脑-肠轴的概念
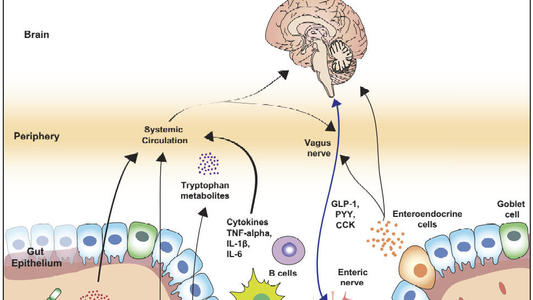
脑肠双向调节在FD的发病中起重要作用,中枢神经系统(C N S)可将脑的各级中枢或脊髓接受的内外环境信息整合后通过自主神经系统(ANS)或神经内分泌系统传至肠神经系统(ENS),ENS可通过传入神经元传递胃肠感觉到CNS,CNS感知胃肠道状态,并通过自主神经传出神经元对胃肠功能进行调节[7-8]。
脑-肠之间通过CNS与ENS形成的这种涉及神经、免疫、内分泌等多种调节机制的双向联结通路即为脑肠轴[9],机
体通过脑肠轴双向环路对胃肠道的调控称为脑-肠互动,脑-肠互动紊乱产生了以胃肠动力与疼痛阈值改变、免疫激活、菌群紊乱、情绪障碍等为主症的消化系疾病。
2脑-肠轴与胃肠道功能
2.1胃肠动力障碍
FD患者胃肠动力障碍主要表现为胃排空延迟与胃容受性舒张功能受损[1],脑与胃肠之间神经-内分泌调节在胃肠动力障碍性疾病中起重要作用。在神经调节方面,胃肠道平滑肌受内在神经和外部神经共同支配,前者包括黏膜下神经丛和肌间神经丛,起局部反射调节作用,后者主要是交感神经和副交感神经通路,交感神经对胃肠道平滑肌有明显的抑制作用,副交感神经对胃肠张力和运动起兴奋性或抑制性作用[10]。
Zheng等[11]研究表明直接经皮电刺激神经可通过抑制交感神经活动,增强迷走神经活动,改善胃肠蠕动,加速胃排空,用来治疗难治性功能性消化不良。脑肠间内分激素调节主要通过脑肠肽来实现,脑肠肽(BGP)是分布于CNS、ENS及胃肠道内分泌细胞的小分子多肽类物质,兼有神经递质传导及激素分泌的双重功能,能够连接和调控脑肠互动的各个环节,参与调节胃肠运动,如对胃肠运动起促进作用的5-羟色胺、促胃液素、胃动素、瘦素等,起抑制作用的血管活性肠多肽、生长抑素、胆囊收缩素等[12],这两者比例的失衡也可能是胃肠动力紊乱的机制之一。
2.2内脏高敏感
内脏高敏感是机体对疼痛和不适的阈值降低。Simren等[13]采用球囊扩张法进行内脏敏感性试验,并对胃肠道及躯体症状进行问卷调查,结果证实内脏高敏反应是FD患者症状产生的重要因素,且内脏高敏感与FD患者症状严重程度呈正相关。目前研究表明内脏高敏的产生与大脑层面的认知和情感唤醒回路及下行调节通路功能障碍有关,内脏传入信号通过自主神经和脊髓通路从肠道传递到大脑,大脑通过以下相关区域对其传入信号进行处理:
①对肠道内稳态状态感知的脑干感觉核、丘脑;②情感唤醒中枢的蓝斑、杏仁核、海马体;③对疼痛刺激反应的前扣带皮质与杏仁核;④下行疼痛调节系统,如中脑导水管周围灰质和延髓头侧腹外侧区接受大脑情感唤醒中枢与皮质调节环路等区域的下行信号,投射至脊髓后脚神经节,整合内脏疼痛信号,而这些与内脏感觉调节有关区域的持续激活及感知通路的异常在FD患者内脏痛觉过敏的产生中起重要作用[14-15]。
因此深入研究脑肠神经传导通路及感觉调节机制,有助于为内脏高敏感相关性疼痛提供新的治疗靶点。Babygirija等[16]目前已用动物模型研究证实非侵入性耳廓经皮神经电刺激可通过调节中枢神经系统中的痛觉区域如杏仁核等减轻内脏痛觉过敏,是一种安全有效的通过中枢神经通路治疗内脏高敏反应的非药物替代疗法。综上所述,脑肠神经调节与内脏高敏感密切相关,未来对其具体机制及靶向治疗尚需进一步研究。
2.3胃肠道免疫和黏膜低度炎症
胃肠道黏膜免疫系统由大量免疫细胞如巨噬细胞、树突状细胞、肥大细胞、嗜酸性粒细胞、淋巴细胞等及内脏相关淋巴组织组成,共同参与调节机体免疫反应[17]。Du等[18]荟萃分析结果显示胃肠黏膜嗜酸性粒细胞、肥大细胞数目增加及脱颗粒释放炎性介质和淋巴细胞群的变化等免疫紊乱与FD的发生有关。
但其具体作用机制尚不清楚,有研究表明中枢神经系统在应激等情况下释放神经递质可能与胃肠道免疫激活有关,应激情况下丘脑分泌促肾上腺皮质激素释放激素,与胃肠黏膜肥大细胞表面的促肾上腺皮质激素释放激素(CRH1、CRH2)受体相结合,促进肥大细胞活化脱颗粒释放炎性介质,引起FD患者胃肠黏膜下神经丛受损,神经纤维兴奋性减弱及神经节结构改变等神经异常,触发胶质细胞释放细胞因子,影响胃肠功能,或直接引起胃肠平滑肌运动障碍,而引发消化不良症状[19-20]。
另外,胃肠道免疫细胞激活后产生的细胞因子也可以通过血液运输或通过作用于胃肠的外周传入神经传递给大脑相应核团,调节大脑活动,激活交感神经系统,引起胃肠功能改变[27]。以上提示胃肠道免疫中脑肠双向调节的重要作用,因此深入研究胃肠免疫系统调节机制,从免疫干预方面着手为免疫异常相关性FD探索新的治疗方法。
2.4肠道微生态
肠道微生物群是人体的正常成分,其数量可达1014,肠道菌群失调与包括FD在内的多种胃肠疾病相关[21]。肠道菌群的改变除与多种免疫炎症状态有关外,还与神经调节障碍有关。研究表明中枢神经系统可通过调节肠道微环境间接影响肠道菌群,其直接信号通常涉及下丘脑-垂体-肾上腺轴(HPA轴)激活后儿茶酚胺类神经递质的释放,间接信号涉及自主神经系统,ANS可调节肠黏膜杯状细胞功能及细胞间上皮通透性,诱导肠道生理变化,从而影响微生物的组成和功能[22]。动物研究结果表明应激导致大脑释放的激素或神经递质,可能会影响细菌的基因表达或细菌之间的信号传递,进而改变微生物群的组成和活性,导致某些菌落优先生长[23]。
Houlden A等[24]诱导小鼠脑损伤模型,发现大脑功能的改变影响自主神经系统去甲肾上腺素的释放,进而改变肠黏膜杯状细胞数量和肠黏膜蛋白的产生,引起肠道微生物群的变化。肠道菌群结构和数量的变化可导致肠黏膜屏障功能改变,黏膜通透性降低,免疫反应激活,促进具有内分泌效应的黏膜上皮产生炎症介质或其他免疫活性物质,穿过肠黏膜屏障进入循环系统,通过血脑屏障入脑,调控大脑功能及高级神经活动,最终引发其下行调节通路胃肠道功能的改变[25]。所以肠道微生物群可能通过脑-肠-菌轴相互作用而引发FD相关的临床症状。
3脑-肠轴与精神心理障碍
近年来有关精神心理因素等与胃肠道疾病间的关系受到越来越多的关注,流行病学调查显示FD与精神障碍共病发生率达42%-61%[26],但其因果关系尚不明确,一方面精神心理障碍可能由慢性胃肠道症状引起,另一方面,功能性胃肠病类似于躯体化障碍,由异常情绪心理反应等引起,表现为胃肠功能紊乱[27]。Koloski等[28]在一项长达12年的前瞻性研究中发现最初没有胃肠病但有明显精神障碍的患者,在随访中出现FD,相反,没有焦虑抑郁等精神障碍的FD患者12年后出现焦虑抑郁的几率显著增加,研究结果说明脑肠双向调节在FD中的重要作用。
其机制可能是精神心理因素及应激、长期慢性压力等破坏了大脑边缘系统与下丘脑间的平衡,引起自主神经系统功能紊乱,交感神经兴奋,迷走神经张力降低,胃收缩频率及传导速度减慢,导致胃肠功能障碍,而长期胃肠道不适症状又反过来影响患者的情绪,从而产生恶性循环导致症状反复甚至加重[29]。
新的脑成像方法如核磁共振成像(fMRI)扫描为FD患者中的神经活动提出了新的见解,fMRI显示FD患者焦虑和抑郁与大脑皮层感觉和稳态传入区域的灰质密度降低有关[30]。Liu等[31]研究发现与健康对照组相比FD患者大脑分布区域的前额叶皮质、后扣带回皮质及顶叶下皮质减少,而这些脑内功能的紊乱与焦虑抑郁有关。上述研究结果从解剖角度证实伴焦虑抑郁等精神障碍的FD的发病与神经系统相关,精神心理因素通过脑-肠轴机制导致消化功能异常。
4结语
综述所述,功能性消化不良发病率高,但其确切发病机制尚未完全阐明。FD的各种发病机制并不是完全独立,而是相互影响,不同的发病机制可能与不同的临床症状有关,不同患者、不同症状或相似症状可能有着不同的发病机制,但各种发病机制与特定症状的关系尚不明确。
本文从胃肠动力、胃脏高敏感、胃肠道免疫与微生态及精神心理因素等五个方面介绍了脑-肠轴与FD发病的相关性,旨在为FD发病机制的研究提供参考。FD症状易复发,造成患者反复就诊,诊治费用逐年上升,目前治疗以药物对症治疗为主,但由于个体差异或药物安全性问题,其治疗只能使部分患者收益,因此对其病因机制的进一步研究有望为FD治疗方案的选择提供新思路。
参考文献
[1]中华医学会消化病学分会胃肠动力学组,中华医学会消化病学分会胃肠功能性疾病协作组.中国功能性消化不良专家共识意见(2015年,上海)[J].中华消化杂志,2016,36(4):217-229.
[2]孙晓红.功能性消化不良的罗马Ⅳ标准解读[J].中华全科医师杂志,2017,16(9):661-663.
[3]Stanghellinii V,Chan FK,Haseler WL,et al.Gastroduodenal Disorders[J].Gast roenterology,2016,150(6):1380-1392.
[4]刘文忠.幽门螺杆菌感染与非溃疡性消化不良[J].现代消化及介入诊疗,2010,15(2):94-97.
[5]Drossman DA.Functional Gastrointestinal Disorders:History,Pathophysiology,Clinical Features,and Rome IV[J].Gastroenterology,2016,150(6):1262-1279.
[6]Tack J,Drossman DA.What’s new in Rome IV?[J].Neurogastroenterology Motility,2017,29(9):e13053.
[7]吴时胜,张飞.胃肠动力、功能性疾病的神经胃肠病学研究[J].中国实用神经疾病志,2014,17(5):95-96.
[8]倪敏,丁义江,丁曙晴.神经调节在功能性胃肠病发病中的作用及其研究进展[J].世界华人消化杂志,2011,19(25):2649-2653.
[9]Breit S,Kupferberg A,Rogler G,et al.Vagus Nerve as Modulator of the Brain-Gut Axis in Psychiatric and Inflammatory Disorders[J].Front Psychiatry,2018,9:44.
[10]Browning KN,Travagli RA.Central nervous system control of gastrointestinal motility and secretion and modulation of gastrointestinal functions[J].Compr Physiol,2014,4(4):1339-1368.
[11]Zheng H,Xu J,Sun X.et al.Electroacupuncture for patients with refractory functional dyspepsia:A randomized controlled trial[J].Neurogastroenterol Motil,2018,30(7):e13316.
[12]高飞,刘铁钢,白辰,等.脑肠轴与胃肠动力之间相关性的研究进展[J].天津中医药大学学报,2018,37(6):520-524.
[13]Simren M,Tornblom H,Palsson OS,et al.Visceral hypersensitivity is associated with GI symptom severity in functional GI disorders:consistent findings from five different patient cohorts[J].Gut,2018,67(2):255-262.
[14]Van Oudenhove L,Crowell MD,Drossman DA,et al.Biopsychosocial Aspects of Functional Gastrointestinal Disorder[J].Gastroenterology,2016,S0016-5085(16):00218-3.
[15]Kano M,Dupont P,Aziz Q,et al.Understanding Neurogastroenterology From Neuroimaging Perspective:A Comprehensive Review of Functional and Structural Brain Imaging in Functional Gastrointestinal Disorders[J].Neurogastroenterol Motil,2018,24(4):512-527.
[16]Babygirija R,Sood M,Kannampalli P,et al.Percutaneous electrical nerve field stimulation modulates central pain pathways and attenuates post-inflammatory visceral and somatic hyperalgesia in rats[J].Neuroscience,2017,356:11-21.
[17]Ahluwalia B,Magnusson MK,Öhman L,Mucosal immune system of the gastrointestinal tract:maintaining balance between the good and the bad[J].Scand.J.Gastroenterol,2017,52(11):1185-1193.
[18]Du L,Chen B,Kim JJ.et al.Micro-inflammation in functional dyspepsia:A systematic review and meta-analysis[J].Neurogastroenterol Motil,2018,30(4):e13304.
[19]Yuan HP,Li Z,Zhang Y,et al.Anxiety and depression are associated with increased counts and degranulation of duodenal mast cells in functional dyspepsia[J].Int J Clin Exp Med,2015,8(5):8010-8014.
[20]Cirillo C,Bessissow T,Desmet AS.et al.Evidence for neuronal and structural changes in submucous ganglia of patients with functional dyspepsia[J].Am.J.Gastroenterol,2015,110(8):1205–1215.
[21]何旭霞,李景南.肠道菌群对脑-肠轴和功能性消化不良的影响[J].胃肠病学,2018,23(10):622-625.
[22]Osadchiy V,Martin CR,Mayer EA.The Gut-Brain Axis and the Microbiome:Mechanisms and Clinical Implications[J].Clin Gastroenterol Hepatol,2019,17(2):322-332.
[23]Cenit MC,Sanz Y,Codoner-Franch P.Influence of gut microbiota on neuropsychiatric disorders[J].Word J Gastroenterol,2017,23(30):5486-5498.
[24]Houlden A,Goldrick M,Brough D,et al.Brain injury induces specific changes in the caecal microbiota of mice via altered autonomic activity and mucoprotein production[J].Brain Behav Immun,2016,57:10-20.
[25]Quigley EMM.The Gut-Brain Axis and the Microbiome:Clues to Pathophysiology and Opportunities for Novel Management Strategies in Irritable Bowel Syndrome(IBS)[J].Clin Med,2018,7(1):6.
[26]李勇,贺丹军,魏睦新.功能性消化不良与精神心理因素的相关性及中药的干预作用[J].世界华人消化杂志,2012,(32):3081-3086.
[27]Powell N,Walker MM,Talley NJ.The mucosal immune system:master regulator of bidirectional gut-brain communications[J].Nat Rev Gastroenterol Hepatol,2017,14(3):143-159.
[28]Koloski NA,Jones M,Kalantar J,et al.The brain–gut pathway in functional gastrointestinal disorders is bidirectional:a 12year prospective population-based study[J].Gut,2012,61(9):1284–1290.
[29]杨昌妮,刘纯伦.精神心理因素与功能性消化不良的相关性研究进展[J].重庆医学,2015,(15):2129-2131.
[30]Zeng F,Qin W,Yang Y,et al.Regional brain structural abnormality in meal-related functional dyspepsia patients:a voxel-based morphometry study[J].PLoS One,2013,8(7):e68383.
[31]Liu P,Wang G,Zeng F,et al.Abnormal brain structure implicated in patients with functional dyspepsia[J].Brain Imaging Behav,2018,12(2):459-466.
关注SCI论文创作发表,寻求SCI论文修改润色、SCI论文代发表等服务支撑,请锁定SCI论文网!
文章出自SCI论文网转载请注明出处:https://www.lunwensci.com/yixuelunwen/11612.html