SCI论文(www.lunwensci.com):
摘要:阿伏伽德罗常数是我国历年高考的重点考点之一,该考点对学生的知识综合理解应用能力较高,既是学生的易得分点也是学生的易失分点。笔者在既有对该内容的研究基础之上,分析阿伏伽德罗常数混合物题型的解题思路,以期对高中化学教学有所裨益。
关键词:阿伏伽德罗常数;混合物;解题思路
本文引用格式:汤素芳,等.浅谈高中化学阿伏伽德罗常数混合物题型的解题思路[J].教育现代化,2019,6(53):247-248,267.
阿伏加德罗常数是中学化学中重要的基本概念,其作用是建立宏观物理量与微观粒子之间的关系[1]。此外,还能够培养学生宏观辨识与微观探析的化学学科核心素养。根据全国新课标要求,该内容在高考中是重要的考点之一。这类试题多考查学生主干知识间的内在联系及综合素养。题目虽较为基础,难度小,但考查面广,综合性强,对考生思维的严谨性和准确性要求高[2]。据查阅文献可得,前人对阿伏伽德罗常数的研究更多是广泛性的对考点分析以及对题目常见陷阱进行逐一突破。在高考试题中,对这一知识点的考查试题出现的频率相当高,占分的比值也较大[3]。但由于一般考生不会系统性地整理该知识点,故该题型成为了考生的易错点、易混淆点以及疑惑点。
一 混合物题型考点剖析
笔者将混合物题型分为显性混合物题型和隐性混合物题型。显性混合物题型即题目直接说明一定量的A与B混合物中,求某微粒个数的多少。例如:(2017·全国卷Ⅱ,8)C.标准状况下,2.24 L N2和O2的混合气体中分子数为0.2NA。对于此类题型,考生可直接读取信息混合物,再从混合物的角度进行分析即可。另一种,隐性混合物题型,即题目没有明确说明是混合物(隐含混合物条件),例如:34 g质量分数为4%的H2O2水溶液中含氧原子数目为0.08 NA,题目求的是过氧化氢溶液中氧原子的个数,大部分考生会直接计算溶液中过氧化氢分子中所含氧原子数目,往往会忽略隐含条件——溶液(溶液中水分子也含有氧原子)。但综合整体上看,高考阿伏伽德罗常数混合物题型主要以考查显性混合物题型为主,因为该题型的考点相对较多,考查知识面更广。
二 解题锦囊
阿伏伽德罗常数常考的内容为:已知物质的质量、体积,物质的量,求粒子的数目,或比较其粒子的数目大小;已知溶液的体积和浓度,求溶液中溶质的粒子的数目或比较其粒子的数目大小;已知粒子的数目,求物质的质量,物质的量,物质的体积,溶液中溶质的粒子的浓度或溶液的浓度;物质在发生氧化还原反应时电子转移的数目[4]。即便是以混合物的题型考查,也只是换汤不换药,万变不离其宗。
(一)一般显性混合物题型——化繁为简,求同存异
对于显性混合物题型,题目往往直接说明一定量的AB混合物中,问某微粒的数目。有关物质微粒种类一般有分子、原子、离子(含原子团)、质子、中子、电子等[5]。此类题型,我们一般都可以化繁为简,求同存异,找出混合物的共性,从而使题目迎刃而解。具体分析如表1所示。
(二)总结
从以上的例题分析中,我们可以知道面对显性混合物题型,考生应当从混合物的最简式出发,找到混合物的最简式本道题即可迎刃而解。具有相同最简式的物质(如NO2和N2O4、乙烯与丙烯、同分异构体、乙炔与苯、乙酸与葡萄糖等),只要总质量一定,则其中所含原子数与两者比例无关[7]。但当混合物无最简式时,考生应当退而求其次,根据题目所求微粒,尝试找出两种物质在该微粒上的共性。此外,考生要注意,此类型题目但凡给出的定量是质量时,我们会发现题目所对应的两种物质的摩尔质量一般情况下是相等的,例如题型2中的②③④⑤,如此将题目化繁为简,求同存异,即可解决问题。
(三)显性混合物题型特例分析
对于显性混合物题型,并非都能用最简式或找共性进行解题,对于一些特例,考生无法直接找出最简式和混合物的共性,此时难度会稍微加大,但依据题目的信息,我们先个别计算再找共性一样可以化繁为简,求同存异。
特例1:8.0 g Cu2S和CuO的混合物中含有铜原子数为0.1 NA(√)解析:此题分子式无最简式也无共性,但对于直接给出质量的显性混合物题型,考生注意一般把关键点放在混合物各物质的摩尔质量上,Cu2S的摩尔质量是160g/mol,CuO的摩尔质量为80g/mol,Cu2S的摩尔质量是CuO的2倍。题目求的微粒数是铜原子的数目,不难发现Cu2Sz中的铜原子数目是CuO的2倍。由于Cu2S和CuO摩尔质量与铜原子个数比均为2:1,利用此共性,结合公式此题即可迎刃而解。特例2:0.1 mol乙烯和乙醇(蒸气)的混合物完全燃烧所消耗的氧原子0.6 NA(√)解析:题目求解的是混合物燃烧所消耗的氧原子数,据此,我们应当分别求出混合中的每1mol乙烯和乙醇与氧气完全燃烧时的耗氧量。根据有机物CxHyOz完全燃烧耗氧量为(x+y/4-z/2)个O2,得每一摩尔的乙烯和乙醇完全燃烧时所消耗的氧气均为3mol,即消耗氧原子均为6mol。故找到了此题的共性,本题即可迎刃而解。从以上的两道特例分析,我们知道,当无法直接找到分子最简式或共性时,可依据题目对两种物质分别进行相关计算后,隐含的共性条件即紧随而来。
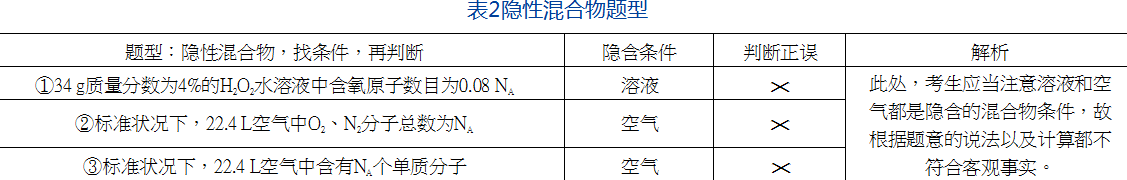
(四)隐性混合物题型——找隐含条件,判断是否符合事实
对于隐性混合物题型,题目没有简单明了地出现“混合物”字眼,往往需要考生多加细心,找出隐含的混合物条件,再判断是否符合客观事实。隐性混合物题型,常见的隐含条件是溶液、空气等,都是日常生活中考生常见的,只要多加细心即可发现,随即再根据题意判断是否符合客观事实即可。例如:②③中,由于空气中除了有O2、N2等单质分子外,还含有其他化合物分子,不符合客观事实即可直接判断错误。
三 总结
关于阿伏伽德罗常数混合物题型,虽整体上考查的知识面广,但考生千万不能被“混合物”一词困扰,要学会沉着冷静,化繁为简,求同存异。学会将该题型分为“显性”和“隐性”,由于隐性混合物题型考点较少,难度较低,考生只要认真审题发现其隐含条件再判断是否符合客观事实即可。而对于显性混合物题型出现的频率相对较高,学生对此要学会三步走:1.找最简式,化部分为整体,以最简式为单位展开计算2.无最简式,根据题目所求微粒找共性3.既无最简式也无直观共性,先个别计算再找共性。如此一来,对此类题目做到知己知彼,方能百战不殆。
参考文献
[1]黎碧存,黄雅康,衷明华.浅谈阿伏伽德罗常数题[J].江西化工,2014(2):179-179.
[2]潘佳绚,衷明华.浅谈阿伏伽德罗常数在全国卷与广东卷中的考查方式和解题策略[J].江西化工,2015(03):128-129.
[3]刘树生,卢达梦,谢永荣.浅析“阿伏加德罗常数”陷阱问题[J].学周刊,2018(12):78-79.
[4]丁淡娜,衷明华.广东高考必考——阿伏加德罗常数的解题思路[J].江西化工,2015(02):248-249.
[5]徐文华.高考有关阿伏伽德罗常数的考查方式面面观[J].数理化学习(高三版),2013(3):50-53
[6]陶秀梅.永远的热点——“阿伏伽德罗常数”的常见考查角度[J].高中数理化,2009(8):52-53.
[7]曾芳,衷明华.浅析广东省必考点之一——阿伏伽德罗常数[J].江西化工,2013(4):56-58.
关注SCI论文创作发表,寻求SCI论文修改润色、SCI论文代发表等服务支撑,请锁定SCI论文网! 文章出自SCI论文网转载请注明出处:https://www.lunwensci.com/jiaoyulunwen/11395.html