摘要:对64批市售金银花中药饮片进行微生物污染情况研究,并对检出频率高的优势污染菌进行分析。采用中国药典2020版四部通则1008检查法,利用microflex LT/SH smart质谱对控制菌及耐热菌检查项检出的污染菌进行鉴定,并评估其危害性。结果表明,在64批的金银花中药饮片检查中,有60批样品分离出可疑菌,其中包含多类不在药典范畴的蜡样芽孢杆菌、肺炎克雷伯菌、阴沟肠杆菌、成团泛菌等优势污染菌。中药饮片中检出的优势污染菌需要引起重视,特别是属于条件致病菌的类别,容易给免疫低下的使用人群带来感染风险。结合用药途径/剂型等方式,尝试建立一个不可接受微生物的危害因子清单,以提供数据参考,从而制定中药饮片不可接受微生物控制策略。
关键词:金银花,不可接受微生物,微生物污染,风险评估
0引言
随着中医诊断的不断壮大,中药饮片的供应需求也在日益增加。而中药饮片大多来自天然动、植物,采收、运输、贮藏和使用过程中都可能存在微生物污染的风险[1-2]。中国药典(ChP)、美国药典(USP)、欧洲药典(EP)、日本药局方(JP)对植物性来源药物规定了微生物限度标准和检查方法[3],要求中药饮片的微生物负载需控制在标准限值内,并且不得检出标准所列的控制菌。由于中药饮片种类繁多,生长环境和条件特殊,容易受到来自土壤、水等环境的微生物污染。因此,现行标准收录的控制菌种类并不能全面控制中药饮片质量。应结合中药饮片微生物负载量、污染微生物特性、给药途径以及用药人群等方面进行风险评估,并将具有潜在危害性的微生物纳入其微生物限度内控标准线。
ChP、美国现行药品生产质量管理规范(cGMP)、USP对不可接受微生物均有定义[4-5]:可能对患者健康造成不可接受风险的微生物。同时,2004—2011年间的一项美国FDA调查研究报告[6-7],发现在144起非无菌产品召回案例中,有72%的召回原因是“不可接受微生物”,其中最常见的是洋葱伯克霍尔德菌(34%)、其他假单孢菌(15%)、肠杆菌(11%)、蜡样芽孢杆菌(9%)以及霉菌和酵母菌(21%)。基于目前国内关于中药饮片中不可接受微生物风险评估方面的文章较少,因此本研究针对64批来自不同产地的金银花中药饮片进行了微生物污染情况的初步评估,并就高频检出的污染菌进行浅析,为企业制定微生物控制策略,提供数据参考。
1材料
1.1仪器
电子天平(日本岛津);AII级生物安全柜(美国Thermo);恒温培养箱(日本三洋);低温培养箱(德国宾得);菌落计数器(西班牙Select);显微镜(德国蔡司);microflex™LT/SH smart微生物鉴定质谱系统(美国布鲁克)。
1.2培养基及试剂
TSA、SDA、VRBGA、MCA、XLD,批号分别为1105971、1105071、1101991、1110991、1092781,均购自广东环凯;革兰氏染色液(Lot M90116)购自法国梅里埃。
1.3试验样品
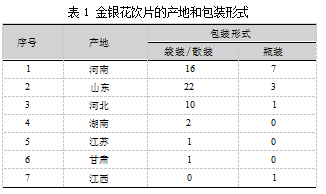
实验样品来自于2022年国家药品评价性抽验项目,共涉及山东、安徽、江西、广东、河北等15个省份38家生产单位的64批样品,如图1所示。
2方法
2.1检测方法
参照中国药典2020年版四部通则1108中药饮片微生物限度检查法依法进行TAMC(需氧菌总数)、TYMC(霉菌和酵母菌总数)、耐热菌、耐胆盐阴性菌、大肠埃希菌和沙门菌检查;采用布鲁克的microflex LT/SH smart鉴定系统(质谱)对VRBGA平板(耐胆盐革兰阴性菌)、MCA平板(大肠埃希菌)和XLD平板(沙门菌)以及耐热菌在TSA平板上出现的可疑菌落,进行微生物群落组成、优势菌属等进行质谱鉴定分析。
2.2结果处理
实验原始数据对数转换,数据结果<10 cfu/g的对数值计为0.5,其他采用对数转换。
3结果
3.1样品产地及包装
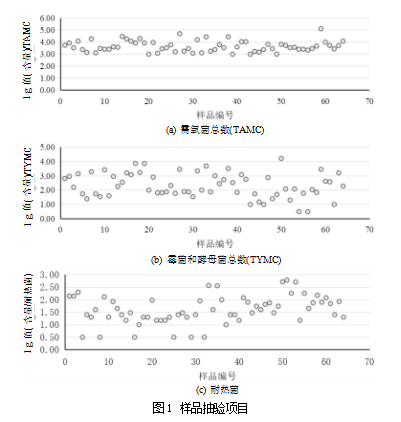
如表1所示,64批金银花饮片的产地分别来自于山东(39%)、河南(36%)、河北(17%)等,共涉及7个省份;包装形式主要有袋装/散装和瓶装,占比分别为81%和19%。结合图1的计数结果分析,98%的样品l gTAMC值在3.0~4.0区间,含菌量大部分在同一个梯度范围内,说明各批间的TAMC差异小,同时结合中药饮片与土壤、水等生长环境的密切相关性,易受到来自土壤和水环境的微生物污染,反映出不同产地、不同包装形式的金银花饮片TAMC微生物污染率基本相近,与多为袋装/散装的包装形式可能存在一定的相关性,饮片存在反复开取使用的过程,受运输存放的温湿度影响较大。此外,陈晓伟、翟华强和ZHU等[8-10]的研究也指出,散装中药可能会因为长时间暴露在空气中、反复开封而导致霉变、虫蛀等性状改变的风险增加。相比之下,小包装中药采用塑料薄膜包装可以有效地避免受周围环境温度、湿度以及鼠患等因素的影响,从而减轻性状改变的程度。
3.2微生物计数结果
如图1所示,金银花饮片98%的样品l gTAMC值在3.0~4.0,均值为3.70,最大值为5.0,细菌含量较高;70%的样品l gTYMC值在2.0~4.0,均值为2.33,最大值为4.2,所有样品均含有霉菌。上述结果表明,金银花饮片微生物污染率普遍较高,即使经加热处理后,耐热菌的检出率依然高达91%,l g值在1.0~3.0之间,均值为1.60,最大值为2.57,提示煎煮工艺不能彻底杀灭微生物,仍有部分耐热菌微生物可以存活。
3.3控制菌检查结果
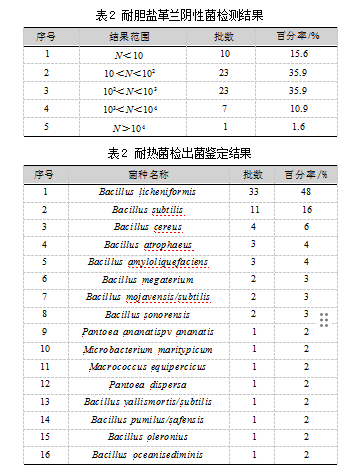
如表2所示,耐胆盐革兰阴性菌检测结果N<10 cfu/g有10批,占15.6%;10 cfu/g<N<102 cfu/g有23批,占35.9%;102 cfu/g<N<103 cfu/g有23批,占35.9%;103 cfu/g<N<104 cfu/g有7批,占10.9%;N>104 cfu/g的有1批,占1.6%,总污染率为81.2%,样品存在耐胆盐革兰阴性菌的污染情况较为严重。在对大肠埃希菌和沙门菌进行检测时,64批金银花饮片均未检出这两类肠道致病菌的存在。
3.4鉴定与分析
3.4.1耐热菌鉴定
进行饮片典型污染菌的分离和鉴定,有助于更深入地了解微生物污染类群及其潜在危害。耐热菌检测是模拟了中药饮片100℃、30 min的煎煮过程,如表2所示。该检查项共检出4类污染菌,68株菌,包含地衣芽孢杆菌Bacillus licheniformis、枯草芽孢杆菌Bacillus subtilis、蜡样芽孢杆菌Bacillus cereus、解淀粉芽孢杆菌Bacillus amyloliquefaciens等条件致病菌,占比分别为48%、16%、6%和4%。检出的菌几乎都是芽孢菌,在恶劣的条件下(如干燥的条件)会形成抗逆性极强的芽孢,即使加热煮沸也无法有效除去[11]。上述结果表明,中药饮片即使经过高温炮制,仍然存在耐热致病菌,这可能会增加免疫力低下患者感染的风险。
3.4.2肠道菌鉴定
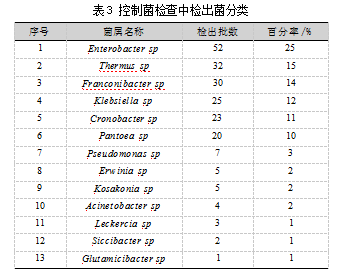
在64批金银花饮片的控制菌检查中,有60批样品检出污染菌,共分离纯化出209株菌,均属于肠道菌范畴,其中检出肠杆菌属Enterobacter sp 52株,包含阴沟肠杆菌Enterobacter cloacae等8类菌,占25%。检出栖热菌属Thermus sp 32株,包含温热泛菌Mixta calida等3类菌,占15%。检出弗兰科尼氏菌属Franconibacter sp30株,包含灰尘弗兰科尼氏菌Franconibacter pulveris等2类菌,占14%。检出克雷伯氏菌属Klebsiella sp 25株,包含肺炎克雷伯菌Klebsiella pneumoniae等3类菌,占12%。检出克罗诺杆菌属Cronobacter sp 23株,包含阪崎肠杆菌Cronobacter sakazakii,占11%。检出泛菌属Pantoea sp 20株,包含成团泛菌Pantoea agglomerans等5种类菌,占10%。检出假单孢菌属Pseudomonas sp 7株,包含绿黄假单孢菌Pseudomonas viridiflava等6种类菌,占3%。检出欧文氏菌属Erwinia sp 5株,占2%。检出科萨克氏菌属Kosakonia sp 5株,包含科文小迫氏菌Kosakonia cowanii,占2%。检出不动杆菌属Acinetobacter sp 4株,包含鲍曼不动杆菌Acinetobacter baumannii,占2%。检出勒克氏菌属Leckercia sp 3株,包含不脱羧莱克勒菌Leclercia adecarboxylata,占1%。检出干燥杆菌属Siccibacter sp 2株,包含马鞭草干燥杆菌Siccibacter colletis,占1%。检出谷氨酸杆菌属Glutamicibacter sp 1株,包含阿里谷氨酸杆菌Glutamicibacter arilaitensis,占1%。13个细菌属分类,如表3所示。
3.4.3肠道菌分析
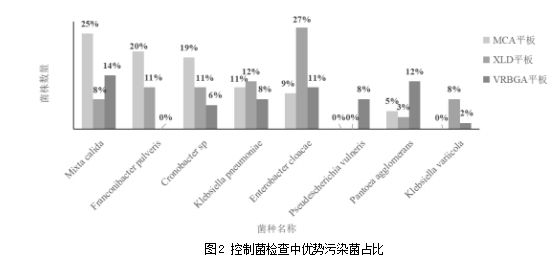
对控制菌平板上的污染菌进行分析,VRBGA平板上检出11类污染菌属,其中,温热泛菌Mixta calida、阴沟肠杆菌Enterobacter cloacae、伤口假埃希菌Pseudescherichia vulneris、肺炎克雷伯菌Klebsiella pneumoniae、克罗诺杆菌属Cronobacter sp的比例最大,分别为14%、11%、8%、8%、6%;XLD平板检测出了12种污染菌,其中包括阴沟肠杆菌、肺炎克雷伯菌、克罗诺杆菌属、灰尘弗兰科尼氏菌Franconibacter pulveris、变栖克雷伯菌Klebsiella variicola是主要的污染菌属,分别占比27%、12%、11%、11%、8%;MCA平板上检出8类污染菌属,其中检出温热泛菌、灰尘弗兰科尼氏菌、克罗诺杆菌属、肺炎克雷伯菌、阴沟肠杆菌占比最高,分别为25%、19%、18%、11%、9%。污染菌以革兰阴性杆菌为主,尤其是肠杆菌科细菌,不同产地的64批金银花中药饮片均检出了阴沟肠杆菌、肺炎克雷伯菌、成团泛菌等优势菌,如图2所示。尽管这几类菌不在药典所规定的范畴内,但归类为条件致病菌,属于不可接受微生物范畴。因此,在检查过程中应特别关注占比较高的优势菌。
4结语
64批金银花饮片的总体微生物负载量较高,有60批样品检测出污染菌,其中包括多种不在药典范畴内的蜡样芽孢杆菌、肺炎克雷伯菌、阴沟肠杆菌和成团泛菌等优势污染菌。这些污染菌大多为条件致病菌,已有文献证明其具有一定的致病性[12-15]。可能会引发心内膜炎、脑膜炎、肺炎和败血症等严重疾病,可引起伤口感染、败血等问题,对免疫力低下的人群尤为危险。近年来,我国已有一些不可接受的微生物污染事件。据报道,有37例成团泛菌感染者中有30例患者是因为静脉输液输入了已被污染的肠道外输液制剂[16]。对于不可接受微生物风险评估的方式,主要基于产品剂型、用药人群、给药途径以及潜在危害等因素。金银花饮片通常作为直接温水冲服或采用煎煮类服用方式使用,但即使采用100℃30 min煎煮过后依然存在蜡样芽孢杆菌等条件致病菌。黄佳慧等[17]的研究也表明,检出不可接受微生物的样品多为含药材原粉的口服给药制剂中成药。其他研究者[18-21]对20个品种共241批中药饮片进行了微生物污染状况考察及研究,并检出了本文所涵盖的优势污染菌属,显示不同药用部位的中药饮片微生物污染优势菌种类趋于相近,可能与这些菌株主要来源相关。同时,中药饮片在生产和运输过程中可能存在微生物污染风险,因此需要加强对加工过程中微生物种群变化的研究,并改善中药饮片的包装形式,提高其微生物安全性评价。鉴于中药饮片普遍存在较高的污染率,急需加强对该行业微生物质量标准的研究。针对检出的优势污染菌,特别是属于条件致病菌的类别,需要引起重视,因为这些污染物容易给免疫低下的使用人群带来感染风险。结合用药途径/剂型等方式,尝试建立一个不可接受微生物危害因子清单,并提供数据参考,以制定中药饮片不可接受微生物控制策略。
参考文献:
[1]国家药典委员会.中华人民共和国药典[M].北京:中国医药科技出版社,2020.
[2]李辉,杨美琴,杨晓莉,等.中药饮片微生物污染研究热点及标准探讨[J].中药材,2021,44(1):224-228.
[3]范一灵,李琼琼,秦峰,等.《美国药典》《欧洲药典》《日本药典》与《中国药典》中中药饮片微生物限度检查及标准的比较研究[J].中国药房,2020,31(22):2695-2700.
[4]SUTTON S V W.What is an“objectionable organism”?[J].American pharmaceutical review,2012,15(6):36-51.
[5]王似锦,余萌,王杠杠,等.非无菌药品中不可接受微生物的控制与风险评估[J].中国药事,2020,34(9):1028-1039.
[6]Parenteral Drug Association Technical Report No.67.Exclusion of objectionable microorganisms from non-sterile pharmaceuticals,medical devices,andcosmetics[R].America:PDA,2014:3-56.
[7]武雅文,王莹,车阳,等.国际微生物污染相关药品召回回顾分析(2013—2019)[J].中国现代应用药学,2021,38(15):1870-1877.
[8]翟华强,田伟兰,李睿,等.中药小包装饮片的历史源流及其调剂规范化操作的思考[J].北京中医药大学学报,2016,39(6):452-455.
[9]陈晓伟,袁晓航.小包装和散装中药饮片对质量控制与含水量的影响研究[J].中医药导报,2020,26(1):18-21.
[10]ZHU C,LI X,ZHANG B,et al.Quantitative analysis of multi-components by single marker-a rational method for the internal quality of chinese herbal medicine[J].Integrative medicine research,2017,6(1):1-11.
[11]杨晓莉,李辉,绳金房.12种中药饮片耐热菌污染状况调查及风险评估[J].陕西中医,2016,37(6):740-743.
[12]卢晓芸,施怡茹,吴丽珠,等.89株蜡样芽孢杆菌食品分离株携带毒力基因情况及PFGE分型研究[J].检验医学与临床,2023,20(1):18-21.
[13]HONG M,WANG Q,TANG Z,et al.Association of genotyping of bacillus cereus with clinical features of post-traumatic endophthalmitis[J].Plos one,2016,11(2):e0147878.
[14]ABFALTER C M,ESTHER S,KARTHE P,et al.Cloning,purification and characterization of the collagenase cola expressed by bacillus cereus atcc 14579[J].Plos one,2016,11(9):e0162433.
[15]陆爽爽,辛玲,沈慧,等.医院获得性肺炎克雷伯菌血流感染119例临床分析[J].中国感染与化疗杂志,2023,23(3):299-305.
[16]沈振,徐晓洁,任丽宏,等.中药颗粒剂中不可接受微生物的溯源分析和风险评估[J].药学研究,2022,41(9):584-587,610.
[17]黄佳慧,何冬华,崔碧玲,等.非无菌药品中泛菌属微生物污染情况及其危害性探讨[J].今日药学,2022,32(4):285-289.
[18]甘永琦,王涛,苏顶,等.通草饮片的微生物污染状况考察[J].华西药学杂志,2018,33(1):52-56.
[19]绳金房,杨晓莉,李辉.陕西省12种中药饮片微生物污染调查及风险评估[J].西北药学杂志,2016,31(6):608-612.
[20]谢文明,张敏,潘建文.常用中药饮片两头尖和桑寄生中微生物污染的检测及分析[J].中国药学杂志,2015,50(18):1630-1633.
[21]李琼琼,范一灵,宋明辉,等.基于高通量测序的6类中药饮片污染微生物群落特征分析[J].药物分析杂志,2019,39(11):1945-1953.
文章出自SCI论文网转载请注明出处:https://www.lunwensci.com/yixuelunwen/82634.html