【摘要】目的:探究程序性细胞死亡受体1(PD-1)抗体免疫治疗联合吉西他滨联合长春瑞滨(GN)方案治疗复发和转移鼻咽恶性肿瘤的效果。方法:选取2015年1月—2021年1月在仙游县总医院就诊的60例复发和转移鼻咽恶性肿瘤患者作为研究对象,随机分为对照组和观察组,每组各30例。对照组行GN方案治疗,观察组则予以PD-1抗体免疫治疗联合GN方案,评价两组的近期疗效及治疗安全性,比较两组治疗前、治疗3个月后血管新生指标[内皮生长因子(VEGF)、胰岛素生长因子-1(IGF-1)、基质金属蛋白酶-9(MMP-9)]、外周血免疫指标[CD3+、CD4+/CD8+、自然杀伤细胞(NK)]水平的差异性,对患者进行为期18个月的随访,绘制Kapan-Meier生存曲线统计患者的生存时间。结果:两组血管的临床疗效有效率分别为60.00%和83.33%,观察组较对照组更高,差异有统计学意义(P<0.05)。治疗3个月后,两组新生指标比较,观察组VEGF、IGF-1以及MMP-9均较对照组更低,差异有统计学意义(P<0.05)。治疗3个月后,两组外周血免疫指标比较,观察组CD3+、CD4+/CD8+均高于对照组,其NK低于对照组,差异有统计学意义(P<0.05)。两组不良反应发生率比较,差异无统计学意义(P>0.05)。观察组生存时间较对照组更长,差异有统计学意义(P<0.05)。结论:PD-1抗体免疫治疗联合GN方案治疗复发和转移鼻咽恶性肿瘤疗效显著,可有效抑制患者肿瘤血管新生,改善其免疫功能,优化短期预后,安全系数较高。
【关键词】鼻咽恶性肿瘤,程序性细胞死亡受体1,吉西他滨,长春瑞滨,疗效,血管新生指标
鼻咽部为恶性肿瘤的好发部位,鼻咽部恶性肿瘤在头颈颌面部肿瘤中占比较高,其最常见的为鼻咽癌,其次为鼻咽淋巴瘤[1]。鼻咽部的恶性肿瘤因发病位置隐蔽,多位于咽隐窝,早期症状不明显,随着肿瘤的增大才会逐步引起重视,导致患者在确诊时已经是局部晚期伴颈部淋巴结转移[2]。对于鼻咽恶性肿瘤,因其约98%为低分化未分化型癌,故而临床通常主张行放射治疗或化疗等综合治疗[3],患者5年生存率可达80%,但仍旧无法排除远处转移以及局部复发的风险[4]。同时亦有研究指出,近1/5的Ⅲ期和Ⅳ期患者由于远处转移使得放化疗的效果欠佳[5]。近年来,肿瘤免疫治疗的研究逐渐成为临床热点[6-7]。研究指出,程序性细胞死亡受体1(PD-1)通路为肿瘤细胞发生免疫逃逸的重要机制之一[8],因此通过阻断PD-1与其配体的结合即可恢复T细胞的活性与抗肿瘤能力。但抗PD-1免疫治疗在鼻咽恶性肿瘤治疗领域的起步较晚,基于此,本研究在常规吉西他滨联合长春瑞滨(GN)方案治疗肿瘤的基础上联合PD-1抗体免疫来对复发和转移鼻咽恶性肿瘤患者进行治疗,旨在探究该法的效果,现报告如下。
1资料与方法
1.1一般资料
选取2015年1月—2021年1月仙游县总医院就诊的60例复发和转移鼻咽恶性肿瘤患者作为研究对象。随机分为对照组和观察组,每组各30例。对照组男10例,女20例;年龄35~68岁,平均年龄(56.14±6.33)岁;复发10例,转移20例;转移部位:肺部11例,肝脏10例,骨头5例,远处转移4例;复发或转移部位数:单个8例,多个22例。观察组男12例,女18例;年龄36~68岁,平均年龄(56.50±6.11)岁;复发12例,转移18例;转移部位:肺部12例,肝脏11例,骨头4例,远处转移3例;复发或转移部位数:单个8例,多个22例。两组一般资料比较,差异无统计学意义(P>0.05),有可比性。本研究已经福建省仙游县总医院伦理委员会审批。
纳入标准:(1)经病理活检确定为鼻咽恶性肿瘤,既往接受过治疗后仍存在复发、转移;(2)预计生存期>3个月;(3)无化疗禁忌症;(4)患者及其家属均知情同意此次研究。排除标准:(1)有严重的全身性或血液系统性疾患,(2)合并第二原发肿瘤,(3)入组前2周合并急性感染,(4)脏器与骨髓功能异常。
1.2方法
对照组行GN方案治疗,化疗前行PICC置管,并加用昂丹司琼预防呕吐,化疗药物经PICC管注入,吉西他滨(Lilly France S.A.S,国药准字为H20020180,0.2 g/瓶)1 000 mg/m2,静滴30 min,d1、d8;长春瑞滨(江苏豪森药业股份有限公司,国药准字为H19990278,1mL:10 mg)25 mg/m2,静脉推注,d1、d8,间隔3周重复,共治疗2个周期。观察组予以PD-1抗体免疫治疗联合GN方案,GN方案参照对照组,静脉推注PD-1单克隆抗体特瑞普利注射液(苏州众合生物医药科技有限公司,国药准字为S20180015,0.24 g/支)2 mg/kg,3周/次,持续治疗4次。治疗期间常规监测血常规、肝肾功能以及电解质,结合具体病情予以降压药物及营养支持治疗。
1.3观察指标
(1)近期疗效。参照WHO肿瘤近期疗效进行评价,评估时间为治疗后3个月。肿瘤完全消失且持续4周以上为痊愈。肿瘤最大纵向直径与最大垂直径乘积较治疗前减少>50%为显效:病灶无显著改变也未出现新病灶为无效:肿瘤病灶直径乘积较治疗前增加>25%或出现新病灶为恶化。总有效率=(痊愈+显效)例数/总例数×100%。(2)血管新生指标。分别于治疗前、治疗后3个月采集患者晨起空腹静脉血2 mL,使用酶联免疫吸附法测定内皮生长因子(VEGF)、胰岛素生长因子-1(IGF-1)以及基质金属蛋白酶-9(MMP-9)水平。(3)外周血免疫指标。分别于治疗前、治疗后3个月采集患者晨起空腹肘静脉血2 mL,使用流式细胞仪检测患者CD3+、CD4+/CD8+、自然杀伤细胞(NK)水平。(4)安全性评价。记录两组患者治疗期间贫血、中性粒细胞减少、胃肠道反应、高血压、白细胞减少等不良反应发生情况。(5)短期预后。通过定期复查与电话对患者进行18个月的随访,记录其生存情况。
1.4统计学处理
数据采用SPSS 21.0软件进行统计分析。计量资料以均数±标准差(x-±s)表示,组间比较采用t检验。计数资料以例数和百分比(%)表示,组间比较采用字2或Fisher检验。以P<0.05为差异有统计学意义。采用Kapan-Meier法制作生存曲线,生存时间的比较采用Log-Rank检验,检验水准为α=0.05。
2结果
2.1两组临床疗效比较
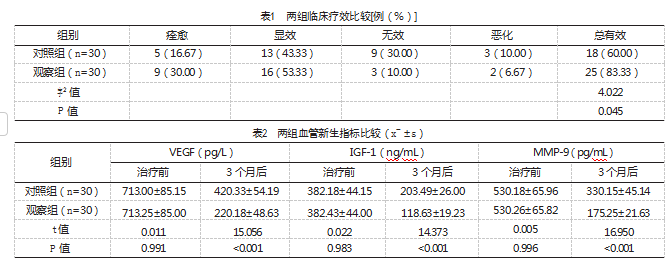
观察组临床疗效有效率较对照组更高,差异有统计学意义(P<0.05),见表1。
2.2两组血管新生指标比较
治疗前,两组VEGF、IGF-1以及MMP-9比较,差异无统计学意义(P>0.05);与治疗前比较,3个月后两组VEGF、IGF-1以及MMP-9均下降,差异有统计学意义(P<0.05);且观察组3个月后VEGF、IGF-1以及MMP-9均较对照组更低,差异有统计学意义(P<0.05)。见表2。
2.3两组外周血免疫指标比较
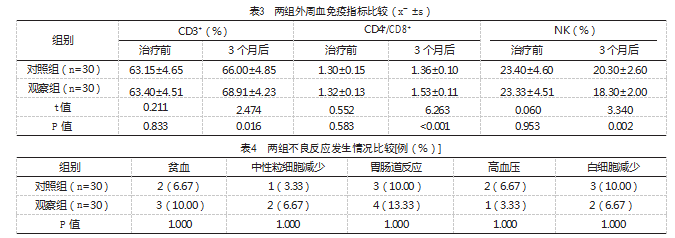
治疗前,两组的CD3+、CD4+/CD8+、NK比较,差异无统计学意义(P>0.05);与治疗前比较,3个月后两组CD3+、CD4+/CD8+均升高,NK下降,差异有统计学意义(P<0.05);且观察组3个月后CD3+、CD4+/CD8+均高于对照组,NK低于对照组,差异有统计学意义(P<0.05)。见表3。
2.4两组不良反应发生情况比较
两组各不良反应发生率比较,差异无统计学意义(P>0.05),见表4。
2.5两组生存时间比较
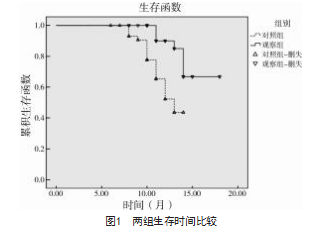
所有病例从首次治疗开始之日算起,观察期为18个月。对照组生存时间为(12.23±0.35)个月,观察组生存时间为(16.32±0.53)个月,观察组生存时间较对照组更长(字2=10.764,P<0.05),见图1。
3讨论
鼻咽部的解剖特点较为复杂,手术难以彻底切除,临床对于该类型肿瘤的治疗原则为最大限度提高局部控制率,降低远处转移,保护靶区周围重要功能器官以及组织,促进患者的预后[9]。但临床实践发现,鼻咽恶性肿瘤在转移到其他部位之前,通常都无明显的症状,超过70%新确诊的病例都被归为局部晚期疾病[10],尽管现代医学诊疗技术在提高患者生存率方面效果显著,但远处转移或者是复发会导致20%~30%的患者死亡[11]。近年来,中晚期恶性肿瘤的治疗从化疗、靶向治疗逐步迈向免疫治疗时代,肿瘤免疫治疗以激发或调动机体的免疫系统、增强肿瘤微环境的抗肿瘤免疫力、控制与杀伤肿瘤细胞为目的,现阶段在临床诸多恶性肿瘤的治疗中皆有应用[12-13]。鼻咽恶性肿瘤的免疫治疗分为两大类,一种是增强机体对肿瘤识别、杀伤能力的主动免疫,另一类则是以免疫检查点抑制剂为代表,使肿瘤免疫状态正常化的方法[14],2020年相关指南也证实推荐PD-1抑制剂用于复发或转移鼻咽癌的一线及二线治疗,并且用于局部晚期鼻咽癌一线治疗的临床研究也在广泛开展,初步结果显示具有较好的应用前景[15]。
PD-1在多种免疫T、B细胞中广泛表达,其参与并影响机体内重要细胞的免疫过程[16]。研究指出,PD-1的配体PD-L1在部分肿瘤细胞中高表达,活化的PD-1/PD-L1系统可显著抑制多种细胞因子的合成分泌,加速细胞毒性T细胞凋亡,削弱机体识别肿瘤细胞的能力,激活肿瘤细胞的免疫逃逸,继而降低抗肿瘤的免疫反应[17]。因此,将PD-L1与PD-1之间的相互作用予以阻断即可提高机体免疫系统的活性,实现治疗肿瘤的目标。特瑞普利为我国首个批准上市的PD-1/PD-L1抑制剂,其能够阻断PD-1/PD-L1信号通路,进而恢复机体免疫系统功能,提升机体对抗肿瘤的能力,在临床黑色素瘤、膀胱癌等疾病中均已证实其治疗效果显著[18-19]。本研究对复发和转移鼻咽恶性肿瘤患者予以PD-1抗体免疫治疗联合GN方案治疗,发现观察组的临床有效率较对照组更高,且观察组的生存时间长于对照组,提示二者联合可进一步提升治疗的效果,延长患者的生存时间,分析可能与化疗和免疫治疗联合应用具有明显的协同效应有关。GN方案化疗有助于快速消退肿瘤并减轻肿瘤负荷,而PD-1抗体免疫治疗的应用可延长这一效应,进而产生持久的抗肿瘤效应,有效发挥抗癌活性,进一步提升疗效;同时特瑞普利可降低PD-1、PD-L1水平,避免肿瘤细胞通过上调PD-1、PD-L1表达逃避免疫监视,解除PD-1介导的免疫抑制作用,重建机体免疫监测功能,提升机体消灭肿瘤细胞的能力。新生血管的生成在临床诸多恶性肿瘤的进程中均发挥着较为重要的作用[20],其关系着肿瘤的生长迁移、浸润以及远处转移[21-22]。本研究发现,3个月后观察组VEGF、IGF-1以及MMP-9均较对照组更低,提示PD-1抗体免疫治疗联合GN方案治疗可抑制鼻咽恶性肿瘤患者肿瘤血管的新生,延缓肿瘤进展。放化疗均会损伤T淋巴细胞,对人体的免疫功能产生不利的影响。本研究中,3个月后观察组CD3+、CD4+/CD8+均高于对照组,其NK低于对照组,提示PD-1抗体免疫治疗的应用可保护鼻咽恶性肿瘤患者的机体T淋巴细胞亚群。分析原因,PD-1和PD-L1均可抑制CD4+、CD8+T淋巴细胞增殖、负性调控机体的免疫应答,有效缓解GN化疗引发的T淋巴细胞亚群损伤,改善NK活性,进而维持机体的正常免疫功能[24]。另外,本研究还发现两组不良反应发生率比较,差异无统计学意义,提示抗体免疫治疗与GN化疗联合不会增加额外的毒副反应,安全系数较高,较为可靠。
综上所述,对转移和复发鼻咽恶性肿瘤患者实施PD-1抗体免疫治疗联合GN方案治疗,可有效抑制肿瘤血管的新生,改善机体免疫功能,延长患者生存时间,有效且安全,在临床实践中的应用前景较好。但本研究仅随访2年,时间较短,后续还需进一步延长随访时间以明析PD-1抗体免疫治疗联合GN方案治疗转移和复发鼻咽恶性肿瘤患者的远期疗效。
参考文献
[1]SIEGEL R L,MILLER K D,FUCHS H E,et al.Cancer statistics,2021[J].CA Cancer J Clin,2021,71(1):7-33.
[2]邓敏鑫,张思毅.窄带成像技术在鼻咽恶性肿瘤中的应用现状[J].国际耳鼻咽喉头颈外科杂志,2018,42(5):264-268.
[3]唐天赐,翟周诗佳,李省苇,等.广义等效均匀剂量优化方法在鼻咽癌调强放射治疗计划中的应用研究[J].中国癌症杂志,2023,33(3):274-281.
[4]林冰,周平,刘沙,等.吉西他滨联合顺铂联合程序性细胞死亡受体1抗体免疫治疗转移性鼻咽癌有效性及安全性分析[J].临床军医杂志,2022,50(6):642-644,648.
[5]邵静,魏鑫鑫,范栩嫚.化疗联合抗PD1免疫检查点抑制剂在复发或转移性鼻咽癌中的治疗效果及其安全性评价[J].实用癌症杂志,2022,37(2):243-246.
[6]解婷,陈天君,王何刚.程序性细胞死亡受体1/程序性死亡受体1配体1抗体联合化疗药物治疗晚期非小细胞肺癌患者的有效性及安全性研究[J].实用心脑肺血管病杂志,2020,28(10):84-88.
[7]刘金燕,张毅.瘤内微生物与肿瘤免疫治疗的研究进展[J].郑州大学学报(医学版),2023,58(3):297-302.
[8]BOUSSIOTIS V A.Molecular and biochemical aspects of the PD-1 checkpoint pathway[J].N Engl J Med,2016,375(18):1767-1778.
[9]薛飞,吴明海.鼻咽癌生物靶向及免疫治疗研究进展[J].医学研究生学报,2022,35(9):982-986.
[10]胡丹,陈志杰,林燕彬,等.基于IMRT同步放化疗方案治疗局部晚期鼻咽癌不良预后危险因素及预测模型构建[J].中国耳鼻咽喉头颈外科,2023,30(3):148-151.
[11]ZHANG Y,CHEN L,HU G Q,et al.Gemcitabine and gisplatin induction chemotherapy innasopharyngeal carcinoma[J].N EnglJ Med,2019,381(12):1124-1135.
[12]李若冰,潘建红,何娟,等.抗肿瘤免疫治疗的长期疗效评价[J].中国新药杂志,2022,31(7):629-634.
[13]田磊,赵昕锐,李洪超.我国肿瘤免疫治疗经济学评价研究现状与挑战[J].卫生经济研究,2021,38(1):35-39.
[14]周凤格,易俊林.鼻咽癌免疫治疗进展[J].中华放射肿瘤学杂志,2021,30(4):407-412.
[15]王瑞莲,谭锦云,卢梓荣,等.鼻咽癌患者经调强放疗序贯抗PD-1免疫治疗后甲状腺功能减退的影响因素[J].实用医学杂志,2021,37(16):2114-2118.
[16]CADER F Z,HU X,GOH W L,et al.A peripheral immune signature of responsiveness to PD-1 blockade inpatients with classical Hodgkin lymphoma[J].Nat Med,2020,26(9):1468-1479.
[17]郝凯峰,张明芳,仲广生.PD-1联合抗血管生成双靶治疗晚期三阴性乳腺癌的疗效及对细胞免疫功能、短期预后和不良反应的影响[J].实用癌症杂志,2022,37(10):1701-1705,1725.
[18]刘芳,董红雨,王叶琳,等.特瑞普利联合新辅助化疗对局部晚期食管癌患者程序性死亡受体1、程序性死亡受体配体1表达水平及术后生存情况的影响[J].中国卫生检验杂志,2023,33(5):520-523.
[19]罗详冲.特瑞普利单抗在恶性肿瘤治疗中的应用[J].中国肿瘤生物治疗杂志,2020,27(8):946-950.
[20]CHEN L,QIU C H,CHEN Y,et al.LncRNA SNHG16 drives proliferation,migration,and invasion of lung cancer cell through modulation of miR-520/VEGF axis[J].Eur Rev Med Pharmacol Sci,2020,24(18):9522-9531.
[21]张金华,田园,杨晓萍.肿瘤血管新生及中医药抗肿瘤血管新生的研究进展[J].新医学,2022,53(1):18-21.
[22]廉莹莹,孙菲,于静萍.肿瘤相关巨噬细胞对肿瘤新生血管生成的作用及其机制的研究进展[J].癌症进展,2022,20(5):433-436.
[23]黄慧,龙亚辉,谭玲霞,等.卡瑞利珠单抗联合白蛋白紫杉醇和顺铂一线治疗晚期食管癌的疗效及对外周血PD-1、PD-L1的影响[J].中国医院用药评价与分析,2022,22(4):444-448.
[24]郑大炜,郭娜,孙辉.调强放疗联合PD-1/PD-L1阻断疗法对中晚期非小细胞肺癌患者免疫状态及近期预后的影响[J].实用癌症杂志,2022,37(7):1165-1169.
文章出自SCI论文网转载请注明出处:https://www.lunwensci.com/yixuelunwen/81662.html