【摘要】目的:研究亚甲蓝(Methylene Blue,MB)注射液治疗感染性休克的效果。方法:选取2021年7月—2022年6月茂名市人民医院收治的80例感染性休克患者为研究对象。根据随机数表法将其分为对照组和观察组,各40例。对照组给予常规治疗,观察组在对照组基础上给予MB注射液。比较两组治疗前(T0)、治疗1 d后(T1)、治疗3 d后(T2)、治疗5 d后(T3)、治疗7 d后(T4)的平均动脉压(mean arterial pressure,MAP)、心率(heart rate,HR)、外周血管阻力指数(systemic vascular resistance index,SVRI)、肺血管阻力指数(pulmonary vascular resistance index,PVRI)、心脏指数(cardiac index,CI)及无创脉搏氧灌注指数(noninvasive pulse oxygen perfusion index,PI),治愈率及不良反应。结果:T2、T3、T4,观察组MAP、HR、SVRI、PVRI、CI、PI均高于对照组,差异有统计学意义(P<0.05)。观察组的治愈率为85.00%(34/40),高于对照组的62.50%(25/40),差异有统计学意义(χ2=5.230,P=0.022)。观察组不良反应发生率与对照组比较,差异无统计学意义(P>0.05)。结论:MB注射液治疗感染性休克能够获得更高的治愈率,有效改善患者机体的血流动力学,治疗安全性较好。
【关键词】感染性休克,亚甲蓝,治愈率,临床效果,安全性,生命体征
感染性休克是全身性感染导致的以一系列器官组织功能损害为临床特征的炎症反应性综合征,一直以来都是重症监护病房(Intensive Care Unit,ICU)常见的主要死亡原因之一。尽快该疾病早已为临床所熟知,但其治疗仍然以抗感染、目标导向液体复苏、缩血管药物应用等方式为主,临床效果欠佳[1]。由此可见,寻求一种高效地、安全的治疗方式提高感染性休克的临床疗效是值得医务工作者高度关注的课题。亚甲蓝(Methylene Blue,MB)是一种一氧化氮(nitric oxide,NO)抑制剂,最早于20世纪初以氯化物形式作为解毒剂应用于临床治疗[2]。近年来,随着MB的动物实验、临床实验等研究相继报道,其已被证实可用于顽固性感染性休克患者的辅助治疗中,可有效改善这类患者血流动力学。有学者在动物实验中也证实了MB可以选择性强抑制鸟苷酸环化酶,进而阻断NO的后续作用。基于此,本研究选取2021年7月—2022年6月茂名市人民医院收治的80例感染性休克患者为研究对象,分析感染性休克患者应用亚甲蓝注射液治疗的临床效果及安全性,报道如下。
1资料与方法
1.1一般资料
选取2021年7月—2022年6月本院收治的80例感染性休克患者为研究对象。纳入标准:年龄18~80岁;均应符合《感染性疾病诊疗指南》中制定的诊断标准[3];临床资料齐全。排除标准:妊娠期女性;对MB已知过敏反应;近期使用过硝酸盐类制剂;近3个月内发生过心肌梗死;治疗过程家属存在抵抗情绪或因其他因素要求自愿退出。根据随机数表法将其分为对照组和观察组,各40例。对照组:男21例,女19例;年龄19~79岁,平均年龄(48.62±2.53)岁;疾病类型:重症肺炎12例,腹腔感染12例,重症胰腺炎8例,败血症5例,颅内感染3例。观察组:男20例,女20例;年龄18~80岁,平均年龄(48.55±2.66)岁;疾病类型:重症肺炎10例,腹腔感染12例,重症胰腺炎9例,败血症6例,颅内感染3例。两组一般资料比较,差异无统计学意义(P>0.05),有可比性。本次研究经医院医学伦理委员会审批并同意,经家属知情同意。
1.2方法
对照组给予常规治疗,给予扩容液、羟乙基淀粉130 0.4氯化钠注射液、20%甘露醇、呋塞米等治疗,实施脱水处理,并尽早应用缩血管药物去甲肾上腺素升压,剂量根据实际血压进行调整,以增加重要脏器灌注,保障脏器功能。在此过程中所有患者均予以连续监测动脉血压、深静脉置管连续监测中心静脉压,以指导输液。
观察组在对照组基础上给予MB注射液(济川药业集团有限公司,国药准字H32024827,规格:2 mL∶20 mg)治疗,给予2 mg/kg的MB注射液进行静脉缓慢注射,注射时间至少15 min,注完之后以同样浓度继续泵注MB注射液2 mL/h,共24 h。
两组均连续治疗7d。
1.3观察指标及评价标准
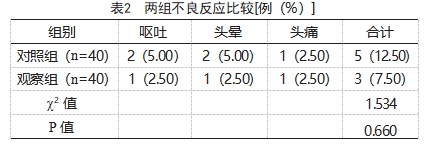
(1)血流动力学指标:比较两组治疗前(T0)、治疗1 d后(T1)、治疗3 d后(T2)、治疗5 d后(T3)、治疗7 d后(T4)的平均动脉压(mean arterial pressure,MAP)、心率(heart rate,HR)、外周血管阻力指数(systemic vascular resistance index,SVRI)、肺血管阻力指数(pulmonary vascular resistance index,PVRI)、心脏指数(cardiac index,CI)及灌注指数(perfusion index,PI)。(2)治愈率:比较两组治愈率。治愈评价标准为治疗后,检测结果显示患者尿、血压、脉压恢复正常,精神意识好转,脉搏、心率规律,判定为治愈。(3)不良反应:记录两组治疗期间不良反应。包括呕吐、头晕、头痛等。
1.4统计学处理
本研究数据采用SPSS 21.0统计学软件进行分析和处理,计量资料以(x-±s)表示,采用t检验,计数资料以率(%)表示,χ2检验,以P<0.05为差异有统计学意义。
2结果
2.1两组不同时间点血流动力学指标比较
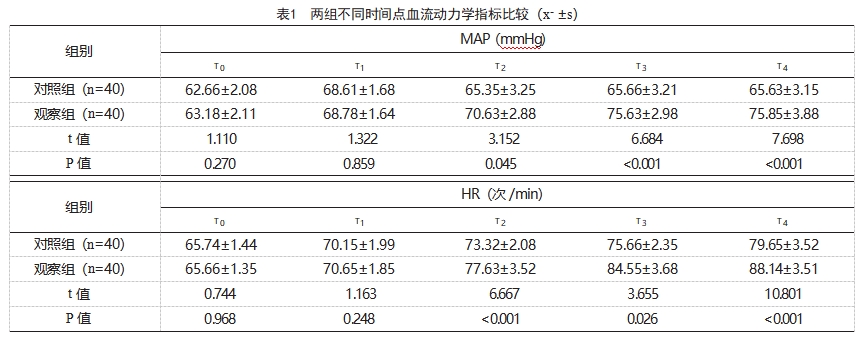
T0、T1时,两组MAP、HR、SVRI、PVRI、CI、PI比较,差异无统计学意义(P>0.05);T2、T3、T4,观察组MAP、HR、SVRI、PVRI、CI、PI均高于对照组,差异有统计学意义(P<0.05),见表1。

3讨论
感染性休克是危重病症中最常见的死亡原因之一,如何提高患者组织灌注、改善组织氧供、降低死亡率是临床医师面临的重大挑战。目前感染性休克患者的临床治疗效果不理想,尤其是重度感染性休克患者的治愈率仅为15%~20%[4]。感染性休克在临床上通常又被称之为脓毒性休克,主要是指由微生物及其分泌的毒素引起的脓毒症综合征伴休克,好发于免疫力弱、体质较差的人群,是治疗难度大、风险高的病症之一。临床通常采用合理的、早期的液体复苏等相关方式进行治疗。但需要指出的是,当液体复苏治疗到一定程度时容易对患者机体组织供氧产生一定程度的影响,引发肺水肿,加重病情,尤其是对血流动力学紊乱的感染性休克患者会产生明显的影响[5]。因此,在常规治疗方式的基础上寻求安全可行的辅助治疗方式对改善感染性休克患者预后至关重要。
早期研究显示,感染性休克患者存在多种炎症因子、细菌内毒素,这些会诱导刺激血管平滑肌和心肌细胞形成一氧化氮,进而合成并释放大量内源性NO,激活鸟苷酸环化酶,合成环磷酸腺苷(cGMP),使得肌细胞膜超极化阻滞,降低对肾上腺素能递质的敏感性,导致内皮平滑肌松弛、血管舒张、末梢循环障碍,引发低血压、心力衰竭、肺水肿、急性多器官损伤甚至器官衰竭[6]。针对上述机制,有学者认为,纠正感染性休克患者血流动力学,使NO合成减少、活性降低,同时阻断NO的后续作用,对改善感染性休克患者症状具有积极的作用[7]。有学者研究指出,NO是阻断细菌内毒素诱导的关键介质,同时也是可逆转感染性休克的关键介质之一。MB作为NO的抑制剂,可使NO合成减少,活性减弱,并阻断NO导致的血管舒张,使心收缩力加强,增加组织氧供[8]。另有研究发现,MB可以阻止感染性休克心肌功能的抑制并维持氧供,其药理机制可能涉及感染性休克患者中血流动力学及氧代谢的改变,而这对于低循环血管阻力、低血压、低组织灌流的感染性休克患者尤为重要[9]。另一方面,李美睿等[10]报道指出,MB改善血流动力学指标的作用是暂时的,长期维持平均动脉血压的升高需要重复连续输注或者加大MB剂量,但其用药安全性难以保障。
既往国内对于MB的应用研究主要集中于动物实验,普遍认为MB的注入可明显增加感染性休克机体的组织灌注。薛晋芳等[11]研究了MB对感染性休克大鼠血流动力学的影响指出,与常规治疗大鼠比较,注入MB的大鼠MAP和HR显著增加。陆雅萍等[12]将MB应用于成人感染性休克患者的治疗中,认为在常规治疗基础上应用MB辅助治疗可有效提高临床治疗效果、改善患者血流动力学异常情况,并指出MB主要是通过氧化亚铁血红蛋白,进而抑制可溶性鸟苷酸环化酶随着对感染性休克发病机制和MB药理机制的理解越来越深入,应用MB治疗感染性休克的临床效果逐渐获得了临床医师和患者的认可。陆雅萍等[12]的研究首次提出了应用MB治疗感染性休克可降低患者住院期间的死亡率,其将54例感染性休克患者随机分为三组,分别基于基础治疗(CG组)、MB单次注射治疗联合基础治疗(MBG组)和MB连续注射治疗联合基础治疗(MBCG组),结果显示MBCG组患者的28 d死亡率明显低于其他两组。
本研究结果显示,T2、T3、T4,观察组MAP、HR、SVRI、PVRI、CI、PI均高于对照组,差异有统计学意义(P<0.05);观察组的治愈率为85.00%(34/40),高于对照组的62.50%(25/40);观察组不良反应发生率低于对照组。可见MB可有效改善感染性休克患者机体内环境,提高患者生存率,分析原因:MB正是基于这一机制抑制了NO的分泌和活性,阻断NO产生的血管舒张,使心收缩力加强,增加组织氧供;同时MB是一种氧化还原剂,可以通过抑制NO合成酶的表达减少内源性NO的合成分泌,并降低NO活性,不会使感染性休克患者会产生明显的反应。
综上所述,MB注射液治疗感染性休克患者能够获得更高的治愈率,有效改善患者机体的血流动力学指标,且不会引起太多不良反应,治疗安全性较好,可为感染性休克的临床治疗提供一条新的思路。
参考文献
[1]徐维,许继元,李茂琴,等.彩色多普勒超声对感染性休克患者急性肾损伤的预测价值[J].中国全科医学,2023,26(9):1104-1111.
[2]王春娟.美国移植和细胞治疗学会系列指南3:造血干细胞移植后巨细胞病毒感染和巨细胞病毒病的防治策略[J].中国感染与化疗杂志,2022,22(5):648-656.
[3]丁梅,刘伟华,李津源,等.亚甲蓝治疗肾移植术中血管麻痹综合征1例[J].中华器官移植杂志,2023,44(5):304-306.
[4]张巧敏,蔡敏杰,张胜,等.亚甲蓝联合硫代硫酸钠成功救治丙烯腈严重烧伤1例[J].中华急诊医学杂志,2022,31(3):426-427.
[5]顾建荣.泌尿道感染伴肾功能不全引起感染性休克1例药学监护[J].中国乡村医药,2023,30(7):43-45.
[6]黄斯瑜,李尔凡,钟丽玲.亚甲蓝光化学疗法血浆病毒灭活技术的应用分析[J].国际医药卫生导报,2014,20(12):1683-1686.
[7]吕文远,汤文喜,魏彭辉,等.亚甲蓝在血管麻痹综合征中的作用[J].国际麻醉学与复苏杂志,2020,41(10):991-995.
[8]王久香,程庆丰,朱深银,等.亚甲蓝介导光动力抗菌化学治疗改善糖尿病下肢溃疡感染的初步临床研究[J].中国全科医学,2021,24(15):1903-1908.
[9]李亚映奇,刘宏宇.感染性休克的常规治疗及臭氧在治疗中的应用进展[J].医学综述,2018,24(18):3669-3672.
[10]李美睿,张广建.罗哌卡因、倍他米松联合亚甲蓝经胸膜外肋间神经阻滞治疗肺癌开胸术后慢性切口痛的疗效观察[J].中华疼痛学杂志,2023,19(1):93-98.
[11]薛晋芳,娄熙冉,陈国兵.亚甲蓝治疗脓毒症及脓毒性休克的研究进展[J].中华危重病急救医学,2021,33(11):1384-1387.
[12]陆雅萍,郁惠杰,刘倩影,等.亚甲蓝持续静脉输注对感染性休克患者的治疗效果[J].中华医学杂志,2019,99(11):868-871.
关注SCI论文创作发表,寻求SCI论文修改润色、SCI论文代发表等服务支撑,请锁定SCI论文网!
本次研究将我院于 2016 年 6 月至 2017 ... 详细>>
如何设计有效的环境治理政策, 是学术界和政策... 详细>>
