SCI论文(www.lunwensci.com):
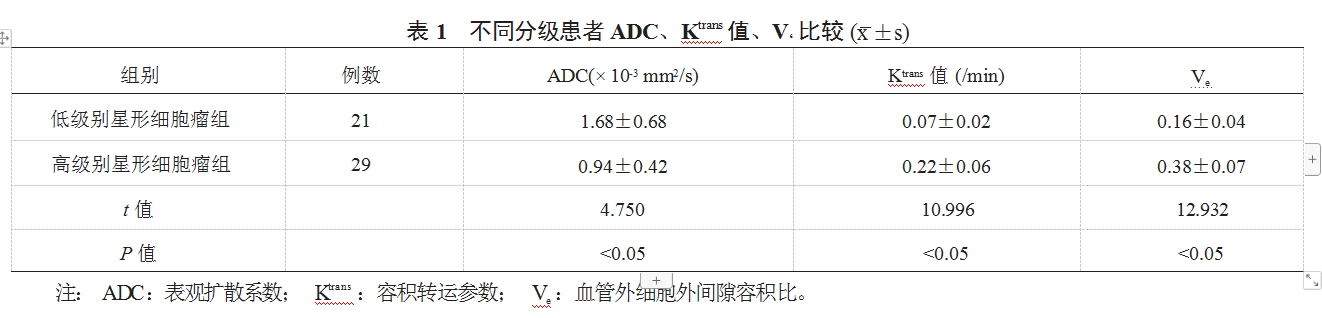
【摘要】目的 探讨多模态磁共振成像对脑星形细胞瘤分级诊断的价值研究,为脑星形细胞瘤病情评估,以及治疗方案的选择提供 科学依据。方法 回顾性分析沭阳医院 2020 年 3 月至 2022 年 3 月收治的 50 例脑星形细胞瘤患者的临床资料, 按世界卫生组织(WHO ) 的肿瘤分级系统,将患者分为低级别星形细胞瘤组(21 例)和高级别星形细胞瘤组(29 例)。术前患者接受动态对比增强磁共振成像 (DCE-MRI )与弥散加权成像(DWI )检查。比较不同分级患者表观扩散系数(ADC )、容积转运参数(Ktrans )、血管外细胞外间隙容 积比( Ve );采用受试者工作特征(ROC )曲线分析 ADC 、Ktrans 值、 Ve 对高级别脑星形细胞瘤的诊断效能;对比分析低级别星形细胞瘤 组与高级别星形细胞瘤典型病例的影像学征象。结果 与低级别星形细胞瘤组比,高级别星形细胞瘤组患者 ADC 更低,而 Ktrans 值、 Ve 更高; ROC 曲线分析显示,ADC 、Ktrans 值、 Ve 预测高级别脑星形细胞瘤的曲线下面积分别为 0.696 、0.757 、0.831 ,其中以 Ve 曲线下面 积及诊断特异度最大,诊断效能最高(均P<0.05 )。 结论 采用多模态磁共振成像可以更加准确地评估脑星形细胞瘤的病变恶性程度, 且 ADC 、Ktrans 值、 Ve 预测高级别脑星形细胞瘤的诊断价值均较高,其中 Ve 诊断价值最高,可为手术的实施和治疗方案的选择提供科学 依据,并能够为预后的评估提供参考。
【关键词】多模态磁共振成像; 脑星形细胞瘤; 分级诊断; 价值研究
随着医学成像技术的不断发展,多模态磁共振成像技 术作为一种新型的医学成像技术,开辟了大脑疾病诊断和 治疗的新途径。其中,脑星形细胞瘤作为一种严重的脑部 肿瘤,其病变范围广泛、生长速度快,对患者的健康造成 了极大危害,因此对其的分级诊断尤为重要。胡平等 [1] 研究报道,脑星形细胞瘤的恶性程度与预后密切相关,对星 形细胞瘤进行精准评估,有助于制定手术方案,同时也 利于患者的预后评估及随访。影像学检查作为诊断颅脑 肿瘤的常用手段,在早期诊断脑星形细胞瘤中起关键作 用。近年来,随着 MRI 技术的不断升级和发展,其在该领域的应用得到了更加广泛的应用和研究,其中动态对 比增强磁共振成像(DCE-MRI)技术能够通过对患者的病 灶部位水分子的分布情况、表观扩散系数(ADC)的量化 分析,综合评估患者病情;此外,DCE-MRI 能够通过三维 重建患者的影像学数据,提高对病情的诊断灵敏度 [2] 。弥 散加权成像(DWI)用于观察组织中的水分子的弥散过 程,其通过利用 MRI 技术,测量水分子在组织中的弥散 运动,从而提供有关组织微观结构和功能的信息。由于 不同组织的水分子弥散速度不同,DWI 能够提供关于组织 类型和病理变化的信息 [3] 。基于此,本研究在探究该技 术在术前诊断脑星形细胞瘤中的潜在作用的同时,进一 步探究了 DCE-MRI 技术与 DWI 技术在该领域应用的互 补性,旨在为提升该疾病的诊疗水平提供依据,现报道 如下。
1 资料与方法
1.1 一般资料 回顾性分析沭阳医院 2020 年 3 月至 2022 年 3 月收治的 50 例脑星形细胞瘤患者的临床资料,按 世界卫生组织(WHO)的肿瘤分级系统 [ 低级别星形细 胞瘤(Ⅰ ~ Ⅱ级),分化及预后良好;高级别星形细胞 瘤(Ⅲ ~ Ⅳ级),低分化且预后差 ] [4] ,将患者分为低级别 星形细胞瘤组(21 例)和高级别星形细胞瘤组(29 例)。 低级别星形细胞瘤组患者中男性 13 例,女性 8 例;年 龄 25~75 岁,平均(52.16±12.43)岁。高级别星形细胞 瘤组患者中男性 19 例,女性 10 例;年龄 25~76 岁,平 均(52.22±12.37)岁。两组患者一般资料比较,差异 无统计学意义(P>0.05),组间可比。纳入标准:①符 合《脑胶质瘤诊疗规范(2018 年版)》[5] 中脑星形细胞瘤 的诊断标准;②未做手术及放化疗于影像检查前;③手 术在影像检查后 2 周内进行。排除标准:①无法接受 DCE-MRI 检查;② DCE-MRI 和 DWI 图像质量差,难以 清晰显示病灶;③有脑手术史。本研究通过沭阳医院医学 伦理委员会审核批准。批准文号为:沭阳伦审(2022)第 (92)号。
1.2 检测方法 术前患者先接受 DWI 检查再行 DCE-MRI 检查,① DWI 检查使用 3.0 T 超导磁共振(MAGNETOMSkyra 3.0 T,德国 Siemens Healthineers)和 16 通道头颈 联合线圈,呈仰卧位检查。扫描序列用单次激发自旋回 波- 回波平面成像(SE-EPI),扫描参数:恢复时间(TE) 为 73 ms,重复时间(TR)为 7 900 ms,激励次数(NEX) 为 4 次,层厚 8 mm,矩阵 128× 130,b=1 000 s/mm2 值进行 加权,测定 ADC 值。
DCE-MRI 检测时采用快速梯度回波脉冲序列扫描, 其参数 TE、TR、将翻转角(FA)、层厚、分辨率、 体素依 次设置为 1.4 ms、4.1 ms、15° 、0.8 mm、446、 0.9 mm×0.8 mm×0.8 mm 。第 1 次扫描后注射钆喷酸葡胺 注射液(北京北陆药业有限公司,国药准字 H10960045, 规格: 20 mL ∶ 9.38 g),然后再行 6 次扫描,每次扫描 30 s,所扫描的序列都定位于同一层面。使用 SE-EPI 扫描 序列测量 ADC 值,其扫描的参数:TE、TR、NEX、层 厚、 b 值、矩阵依次为: 77 ms、5 300 ms、4 次、 5 mm、 1 000 s/mm2 、160× 130。
图像处理分析:将扫描的图像数据上传到 GE 处理工 作站,分别通过 2 名具备 5 年以上的中枢神经系统阅片的 丰富经验医师,在同层面 ADC 图像上,避开坏死、钙化 意见囊变区,且于相同位置勾画出感兴趣区(ROI), 容 积转运参数(Ktrans )、血管外细胞外间隙容积比(Ve )的 参数值,然后取平均值。
1.3 观察指标 ①比较两组患者 ADC、Ktrans、Ve 的参数值。 ②应用受试者工作特征(ROC)曲线分析 ADC、Ktrans 值、 Ve 对高级别脑星形细胞瘤的诊断价值。③分析两组患者 典型病例影像学特征。
1.4 统计学方法 应用 SPSS 24.0 统计学软件分析数据, 计量资料经 S-W 法检验证实符合正态分布且方差齐,以 (x ±s) 表示,采用t 检验;采用 ROC 曲线分析 ADC、Ktrans 值、Ve 对高级别脑星形细胞瘤的诊断价值。以P<0.05 为差 异有统计学意义。
2 结果
2.1 两组患者 ADC、Ktrans 值、V‘ 比较 与低级别星形细 胞瘤组比,高级别星形细胞瘤组患者 ADC 更低,而 Ktrans 值、Ve 更高,差异均有统计学意义(均P<0.05),见表 1。
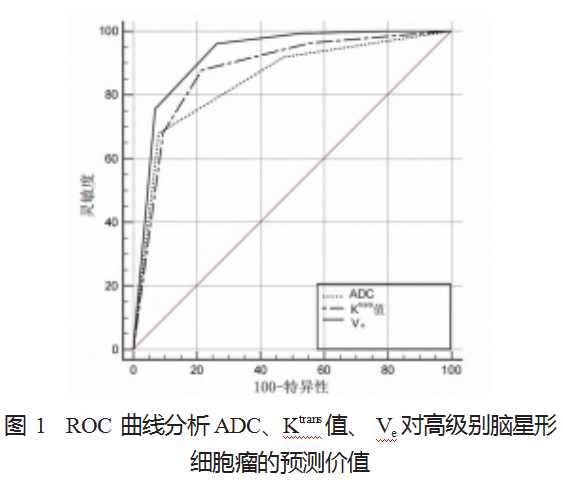
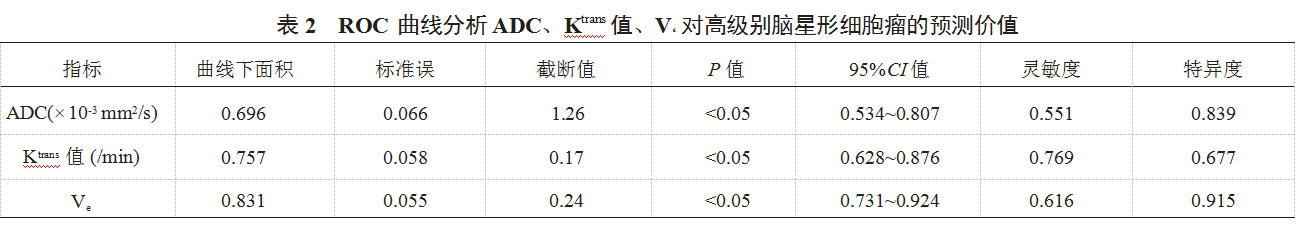
2.2 ROC 曲线分析 ADC、Ktrans 值、V‘ 对高级别脑星形 细胞瘤的预测价值 ADC、Ktrans 值、Ve 预测高级别脑星 形细胞瘤的曲线下面积分别为 0.696、0.757、0.831,其中 Ve 曲线下面积及特异度均最大, 均具有诊断价值(均 P<0.05),见表 2、见图 1。
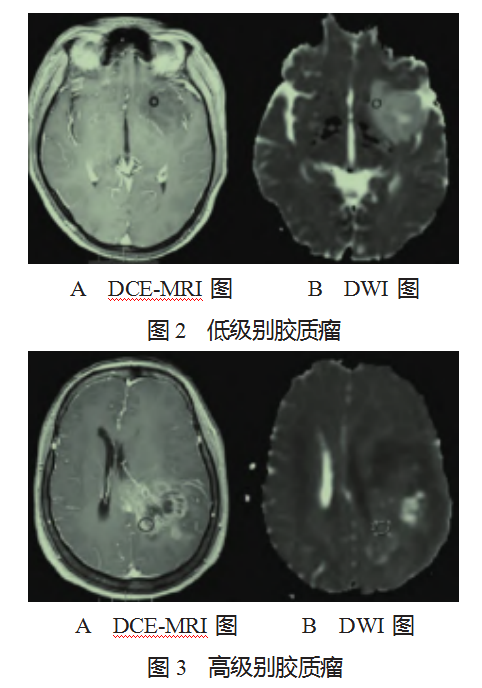
2.3 典型病例分析 患者 1:男,42 岁,左侧颞叶弥漫星 形细胞瘤,WHO Ⅱ级,图像检查 T1 轴位增强和 ADC 图, 图中显示低级别胶质瘤,Ve 值为 0.16,Ktrans 值为 0.09/min, ADC 值为 1.51× 10-3 mm2/s。在 DCE-MRI 图片中表现为 不明显强化,见图 2-A;在 DWI 图片中呈现低信号强 度,呈圆形或椭圆形,边界清晰,与周围正常脑组织有明显分界,密度较低,见图 2-B。患者 2:女,65 岁,左 顶叶胶质母细胞瘤,为 WHO Ⅳ级,图像检查轴位增强和 ADC 图,图中显示高级别胶质瘤,Ve 值为 0.41,Ktrans 值为 0.23/min,ADC 值为 0.92× 10-3 mm2/s。在 DCE-MRI 图片中 表现为明显的强化,见图 3-A;在 DWI 图片中呈现高信 号强度区域,边界较模糊,不规则,病灶周围形成弥漫性 浸润区域,见图 3-B。
3 讨论
脑星形细胞瘤是一种起源于星形细胞的恶性肿瘤, 星形细胞是大脑和脊髓中最常见的细胞类型之一,具有支 持和营养神经组织的功能。脑星形细胞瘤可以分为多个 亚型,包括低级别星形细胞瘤和高级别星形细胞瘤,高级 别的星形细胞瘤具有低分化和强浸润性,因此通过手术难 以完全切除,需要辅助放疗和化疗,并且容易复发。相比之下,低级别的星形细胞瘤分化良好,增殖性强,可以通 过手术切除 [6] 。脑星形细胞瘤是一种较为常见的神经系统 肿瘤,由于其病变位置和临床表现的多样性,在不同的治 疗方案和预后评估方面存在一定的困难 [7] 。因此,进行准 确的术前诊断和评估对于治疗方案的选择和预后评估至关 重要。
DCE-MRI 联合 DWI 术前诊断,是一种新型的医疗诊 断技术,可用于脑星形细胞瘤的相关参数和病变恶性程度 的评估。其中 DCE-MRI 在 MRI 扫描的过程中注入一种可 被 MRI 所识别的显影剂,使细胞外组织液顺磁性地分布 在扫描范围内,通过该显影剂与肿瘤组织的血供和代谢活 性的变化,可对肿瘤的恶性程度和血管生成等关键参数进 行客观定量的评估;而 DWI 技术则可以对肿瘤的分子扩 散进行定量描述,进一步提高病灶的可见性和准确度 [8] 。 ADC 是 DWI 技术中常用的量化指标,反映了组织的扩散 能力,可以用来评估脑星形细胞瘤的恶性程度和预测其治 疗反应。
张丽玲等 [9] 研究表明,脑星形细胞瘤的分级与 ADC 值有一定关系, 一般来说, 高分级的脑星形细胞瘤ADC 值 较低,低分级的脑星形细胞瘤 ADC 值较高。这可能与恶 性脑星形细胞瘤细胞的增殖和肿瘤细胞排列紧密程度较高有关,使得 ADC值偏低;Ktrans 代表了血管内的对比剂向 组织间的转运速率,反映了血管壁的通透性和血管内外的 物质交换情况。 Ktrans 值越高, 说明血管壁通透性越大, 物 质交换越频繁,可能意味着肿瘤组织的血管新生较活跃; Ve 反映了肿瘤组织中血浆体积的百分比, 即组织中血管容 积的比例, Ve 值越高, 说明肿瘤组织中血管容积越大, 可 能表示肿瘤血管密度较高。低级别胶质瘤通常具有较低的 Ktrans 值和Ve 值,这是因为低级别胶质瘤的血管通透性和血 管生成程度相对较低;而在高级别胶质瘤通常具有较高的 Ktrans 值和Ve 值,因高级别胶质瘤的血管通透性和血管生成 程度相对较高,高级别胶质瘤的恶性程度较高,血管生成 活跃, 血管通透性增加。ADC、Ktrans 值及 Ve 是通过磁共振 成像技术获得的参数,反映了高级别脑星形细胞瘤在水分 子扩散、血管生成及细胞间隙容积等方面的病理改变。这 些参数的测量可以帮助医师了解病变的组织学特征和恶性 程度,对高级别脑星形细胞瘤的诊断和治疗方案的选择具 有重要意义 [10]。本研究结果显示, 与低级别星形细胞瘤组 比,高级别星形细胞瘤组患者 ADC 更低,而 Ktrans 值、 Ve 更高,提示其恶性程度越高,肿瘤内新生血管细胞畸形则 越多,同时也会增加血管密度。
DCE-MRI 联合 DWI 术前诊断对高级别星形细胞瘤的 意义在于提供了对肿瘤的血流动力学特征和细胞组织特征 的评估。通过测量 ADC、Ktrans 及 Ve 值,可以提供有关肿 瘤血供、血管渗透性等信息,这对于评估肿瘤的恶性程 度、预测治疗效果,以及制定个体化治疗方案非常重要。 此外, DCE-MRI 联合 DWI 还可以提供血流动力学参数和 组织学信息的定量测量,从而有助于更准确地评估肿瘤的 生物学特性和临床预后 [11]。本研究结果中,ROC 曲线分 析显示, ADC、Ktrans 值、 Ve 预测高级别脑星形细胞瘤的曲 线下面积分别为 0.696、0.757、0.831,其中 Ve 曲线下面积 及特异度均最大,说明 ADC、Ktrans 值、 Ve 对高级别脑星 形细胞瘤的诊断价值均较高,其中 Ve 诊断价值最高,可 为手术的实施和治疗方案的选择提供科学依据,并能够为 预后的评估提供参考。分析其原因, ADC 在高级别胶质瘤 中, 细胞密度增加, 细胞间隙变小, ADC 值会降低, 这是 因为细胞密度增加会限制水分子的扩散,导致 ADC 值减 小。 Ktrans 在高级别胶质瘤中, 血管生成增加, 血管通透性 增强, 导致 Ktrans 值升高, 这是因为血管生成的增加会增加 血管通透性, 并导致更多的造影剂渗入组织。 Ve 在高级别 胶质瘤中, 血管生成增加, 血管通透性增强, 导致 Ve 值升 高。虽然 ADC 和 Ktrans 值在高级别胶质瘤中也可能有一定 的变化, 但 Ve 可以综合反映血管密度、通透性及血流灌注 度的综合情况。 Ve 在评估肿瘤治疗反应和预后方面具有重 要意义;高级别胶质瘤的治疗通常包括手术切除、放射治疗及化疗等多种方法, 而Ve 可以作为评估治疗反应的重要 指标。 ADC、Ktrans 值及 Ve 值在诊断高级别胶质瘤病变时 可以用于定量评估病变的程度和恶性程度,辅助医师进行 诊断和分级。但由于 Ve 能够更全面地反映肿瘤的血管特 征和治疗反应,对于指导临床治疗和评估预后具有重要意 义, 因此, Ve 在高级别胶质瘤中的诊断价值高于 ADC 和 Ktrans 值 [12]。
综上,采用多模态磁共振成像,可以更加准确地评估 脑星形细胞瘤的病变恶性程度, 且 ADC、Ktrans 值、Ve 预测 高级别脑星形细胞瘤的诊断价值均较高, 其中Ve 诊断价值 最高,可为手术的实施和治疗方案的选择提供科学依据, 并能够为预后的评估提供参考。
参考文献
[1] 胡平 , 叶立果 , 江洪祥 , 等 . 高级磁共振成像技术在脑星形细 胞瘤分级诊断中的应用进展 [J]. 中国临床神经外科杂志 , 2022,27(4): 314-316.
[2] 黄鼎祥 , 艾信平 . 磁共振动态对比增强联合扩散峰度成像在脑胶 质瘤分级中的价值分析 [J]. 医疗卫生装备 , 2019, 40(8): 42-45.
[3] 周瑞清 . MRI 扫描对脑胶质瘤诊断以及分级的应用价值分析 [J]. 影像研究与医学应用 , 2022, 6(20): 107-109.
[4] 杜伟 , 陈义兵 , 魏新亭 . 2016 版《WHO 中枢神经系统肿瘤分类》 更新解读 [J]. 中华神经外科杂志 , 2016, 32(11): 1095-1098.
[5] 国家卫生健康委员会医政医管局 . 脑胶质瘤诊疗规范 (2018 年 版 )[J]. 中华神经外科杂志 , 2019, 35(3): 217-239.
[6] 张磊 , 文利 , 张冬 , 等 . 磁共振动态磁敏感对比增强成像在术前 脑胶质瘤分级诊断及 IDH 突变状态评估中的应用价值 [J]. 现代 肿瘤医学 , 2020, 28(21): 3779-3785.
[7] 徐华 , 彭东 , 鲁龙龙 . 术前 MRI 增强扫描对脑胶质瘤病理分级诊 断及其与微血管密度的相关性 [J]. 中国 CT 和 MRI 杂志 , 2020,18(2): 48-50.
[8] 范文骏 , 马林 . DCE-MRI 及 IVIM-DWI 在头颈部恶性肿瘤诊疗 中的研究进展 [J]. 国际医学放射学杂志 , 2019, 42(5): 556-560.
[9] 张丽玲 , 丁爽 . DWI 视觉尺度评估及 ADC 值测量在未强化胶质 瘤分级判定中的对比研究 [J]. 中国 CT 和 MRI 杂志, 2022, 20(6):15-17.
[10] 袁姝娅 , 邱俊 , 邓克学 . DCE-MRI 联合 DWI 检查在脑星形细 胞瘤分级诊断中的应用 [J]. 立体定向和功能性神经外科杂志 ,2021, 34(6): 358-361.
[11] 王大堃 , 朱建忠 , 刘辉 , 等 . DCE-MRI 测量 K(trans) 值、Ve 值联 合 ADC 值与脑胶质瘤患者 MVD 及病理分期的相关性 [J]. 中国 临床医学影像杂志 , 2020, 31(11): 766-769.
[12] 李文静 , 敖锋 , 张自力 . 多模态磁共振成像诊断高级别胶质细胞 瘤一例影像表现分析 [J].山西医药杂志, 2017, 46(21): 2580-2581.
关注SCI论文创作发表,寻求SCI论文修改润色、SCI论文代发表等服务支撑,请锁定SCI论文网!
文章出自SCI论文网转载请注明出处:https://www.lunwensci.com/yixuelunwen/76130.html