SCI论文(www.lunwensci.com):
【摘要】目的 探讨结肠韧带孤立性纤维性肿瘤(solitary fibrous tumor,SFT )的影像学、临床病理特点及患者预后情况。方法 对 1 例结肠韧带 SFT 患者进行影像学鉴别检查(包括 CT 、超声造影、核磁共振检查等) ,后通过手术及病理诊断该病例属于罕见结肠韧带 SFT,总结该病例的相关检查、诊断、手术治疗与术后随访过程。结果 患者胃结肠网膜近胃底处结肠韧带可见肿物, 肿物肉眼观灰褐色, 表面光滑可见血管扩张, 切面灰白、实性质中, 中央可见钙化灶。镜下特点:镜下瘤细胞周界清晰, 呈交织状或席纹状排列, 局部呈纤细 梭形, 血管丰富。免疫组织化学染色:STAT-6 、CD34 阳性, Ki-67(3%+ ), SALL-4 、CD117 、S-100 阴性。术后随访 2 个月, 无复发, 患者一般情况良好。结论 结肠韧带 SFT 疾病较罕见,鉴别诊断主要依靠病理变化和免疫表型,治疗以手术完整切除肿瘤为主,且术后 应对患者进行长期随访。
【关键词】结肠韧带; 孤立性纤维性肿瘤; 免疫组织化学染色; 超声造影; 增强核磁
孤立性纤维性肿瘤(solitary fibrous tumor,SFT)是一 种较为罕见的间叶细胞来源的梭形细胞肿瘤,呈缓慢生长 和逐渐加重,目前其病因尚不清楚,可能与遗传、环境等 多种因素相关。SFT 起源于 CD34 阳性的树突状间叶细胞, 此类型细胞弥漫分布于人体结缔组织中,此肿瘤可发生于 身体各个部位,最常见于胸膜,其次为盆腹腔,发生于结 肠韧带较罕见。目前手术切除是治疗结肠韧带 SFT 的主 要方法,若手术彻底切除干净可治愈,但也有发生恶性病 变的报道。由于其组织学的复杂性和多样性,发生部位广 泛,较少见且往往缺乏对该病的认识,临床上极易与其他 肿瘤相混淆。本文现报道 1 例结肠韧带 SFT 患者,通过 影像学鉴别检查、手术切除治疗及术后病理诊断过程总结 该病例的相关检查、诊断及预后,现阐述如下。
1 病例资料
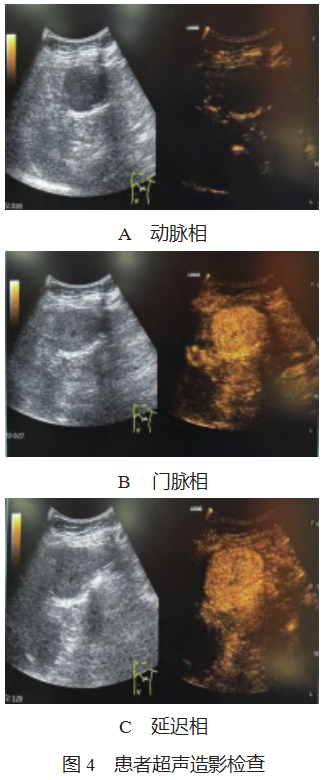
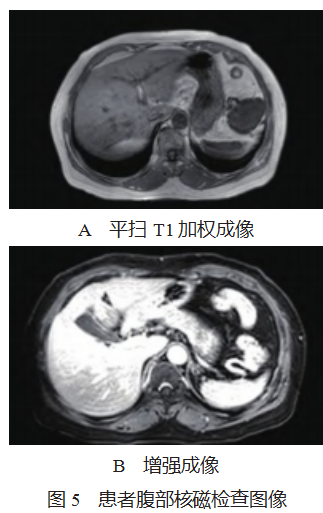
患者,女性,62 岁,因上腹不适于 2023 年 4 月初行 肾 CT 检查,提示左上腹肿物,见图 1 。4 月 20 日行超声 检查提示:左上腹部(脾脏内侧,胃底外侧)一大小约 6.5 cm×4.8 cm×6.1 cm 低回声实性团块, 边界清晰, 形态规 整,内部回声欠均匀, 可见不规则无回声区, 彩色多普勒血 流显像(CDFI):内部及周边血流信号较丰富, 可见一粗 大血管供应肿物, 其来源未明确, 见图 2。饮水后观察该团 块位于胃底前方, 与胃、脾、肾无关, 考虑来源于系膜, 见 图 3。2023 年 5 月 6 日行超声造影检查:肘静脉团注注射用 六氟化硫微泡(Bracco Suisse SA,注册证号 HJ20171213, 规格: 59 mg 六氟化硫),动脉期:可见粗大血管从肿物边缘向内开始灌注,呈周边向中央不均匀性增强;门脉期: 呈高增强,中央部分低增强;延迟期:中央区低增强基本 廓清,周围呈等增强,其相邻脾脏灌注及撤退模式均与该 团块不同,见图 4-A、4-B、4-C,考虑间质瘤(来源于肠 系膜),不除外其他新生性肿瘤可能。2023 年 5 月 10 日 行腹部核磁平扫及增强检查:左上腹膈下脾脏前上方椭圆 形稍长 T1、稍长 T2 信号肿物。核磁增强:病灶强化,其 旁可见脾动脉分支延伸入病灶内,考虑左上腹脾外血管瘤 (脾动脉供血)或肠系膜间质瘤,见图 5-A、5-B。
患者入院情况:无腹痛、腹胀、腹泻, 无发热、寒战; 无便血及黏液血便;无尿频、尿急、尿痛。自患者患病以 来, 精神、饮食、睡眠良好, 大小便正常。体格检查:腹部 平坦,腹肌柔软,未见腹壁静脉曲张,无压痛,叩击痛, 肠鸣音正常。实验室检查:白细胞:9.82× 109/L ;红细胞: 4.69× 1012/L;血小板: 180.00× 109/L;随机血糖6.03 mmol/L; 糖类抗原 125(CA125)11.08 U/mL ;甲胎蛋白(AFP ) 3.67 ng/mL;糖类抗原 199(CA199)3.83 U/mL ;糖类抗 原 153(CA153)4.29 U/mL;癌胚抗原(CEA)0.96 ng/mL。
2 方法与结果
2.1 研究方法 患者于 2023 年 5 月 19 日进行全麻下腹 腔镜手术:腹腔未见游离积液,肝脏表面光滑,大小正 常,于胃结肠网膜近胃底处可见肿物,约 8 cm×6 cm×6 cm, 呈椭圆形,表面光滑,包膜光整。在肿物与横结肠之间 切开胃结肠网膜,见肿物与横结肠、胃、脾脏无明显黏 连。游离肿物上方及下方网膜,见肿物后方有血管供应,切除肿块。将切除的病灶标本经 10% 中性福尔马林 固定,石蜡包埋,3 μm厚连续切片。首先,进行常规苏木 精- 伊红(HE)染色,镜检,观察组织病理学变化;同时 行 SP 免疫组织化学染色,检测肿瘤组织中转录活化子 6 ( STAT-6 ),CD34,人类婆罗双树样基因 4( SALL-4 ), CD117,S-100,Ki-67 表达情况(所用抗体均购自于北 京中杉金桥公司,具体操作步骤严格按试剂盒说明书进 行)。其中 STAT-6,CD34,SALL-4,CD117,S-100 阳性 判定标准:细胞染色强度计分:无着色为 0 分,淡黄色 为 1 分,棕黄色为 2 分,棕褐色为 3 分;阳性细胞所占 百分比计分:<5% 为 0 分, 5%~25% 为 1 分,26%~50% 为 2 分,51%~75% 为 3 分,>75% 为 4分;两项得分结果相 加 <3 分为阴性, ≥3 分为阳性 [1];Ki-67 阳性判定标准: 随机选择 10 个高倍视野(40× ),每个视野数 100 个细胞, 计数阳性细胞(细胞核呈棕褐色)占总细胞的占比,取平 均值, Ki-67 阳性 = 阳性细胞个数 /1 000× 100% [2]。
2.2 结果
2.2.1 眼观 标本为灰褐色组织 1 个,大小 5 cm×4.5 cm× 3 cm ,表面光滑,可见血管扩张,切面灰白、实性质,中 央可见钙化,见图 6-A、图 6-B。
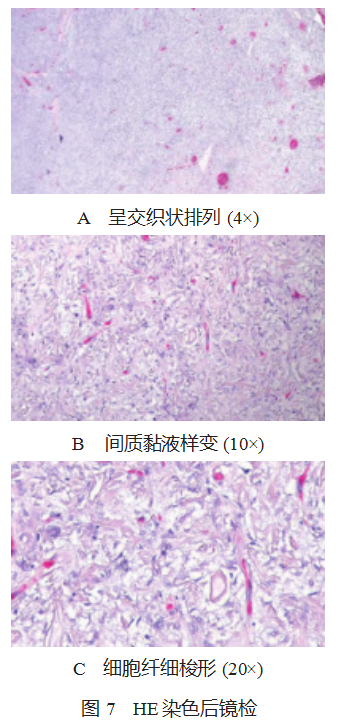
2.2.2 镜检 肿瘤细胞呈交织状或席纹状排列,细胞呈卵 圆形,局部呈纤细梭形,血管丰富,细胞温和,核分裂象 少见,没有坏死,间质可见黏液变性及形态不一的胶原纤 维,见图 7-A、7-B、7-C。
2.2.3 免疫组织化学结果 免疫组织化学染色结果显示, STAT-6,在梭形肿瘤细胞核阳性,呈棕褐色染色,阳性细 胞占比 <90%,肿瘤细胞旁组织阴性,见图 8-A;CD34, 梭形肿瘤细胞浆阳性,肿瘤细胞旁的对照血管也呈细胞 浆阳性,呈棕褐色染色,阳性细胞占比 <90%,见图 8-B; SALL-4 无阳性细胞,呈阴性表达,见图 8-C;肿物增殖 指数 Ki-67 低,每高倍视野约 3%+,呈散在细胞核棕褐 色染色,见图 8-D;CD117 梭形肿瘤细胞阴性,肿瘤周围 的肥大细胞阳性,见图 8-E;S-100 无阳性细胞,呈阴性表 达,见图 8-F。
2.2.4 病理诊断 梭形细胞黏液样肿瘤,结合形态及免 疫组织化学染色,符合 SFT(注:SFT ICD-O 编码 8815/1, 低度恶性)。
2.2.5 随访 术后患者出现肺部感染,给予抗感染、补 液、祛痰等相关治疗后好转出院。术后随访 2 个月未见肿 瘤复发, 一般情况良好。
3 讨论
3.1 病因及组织来源 SFT 是一种罕见的间叶组织来源 的肿瘤,发病部位广泛,好发部位多为深部躯体软组织和体腔部位。病因尚不清楚,结肠韧带 SFT 较为罕见。根 据 2020 世界卫生组织(WHO)的分类 [3],SFT 的生物学行 为介于良性和恶性肿瘤之间,多数呈相对惰性,发生转移 的风险较低。
3.2 临床特点 SFT 好发于 50~60 岁人群,无明显性别 差异 [4] ,可发生在全身任何部位。临床具体表现和肿瘤的 发生部位有关,因盆腹腔空间大,当肿瘤出现压迫症状时 才被发现,发病较隐匿。SFT 术后复发率 8%~13%,远处 转移率 10%~20% [5]。
3.3 影像学诊断 SFT 最常见的超声表现为边界清楚、 边缘光滑的圆形或椭圆形实质性肿块,低回声或中等回 声,回声均匀或欠均匀,血流丰富,多呈分枝状彩色血 流,血管阻力较小 [6] 。本例肿物呈边界清楚,形态规则的 低回声,位于胃底和脾脏之间,与胃底关系密切,为排除来源于胃底的外生性间质瘤,饮水后发现其与胃壁无关,进一步超声造影表现为粗大血管供应的“快进慢退”不均匀增强,考虑可能与肿块血供来源于脾动脉分支有关,其内低增强考虑部分坏死。核磁成像中良性病灶均为单发,肿瘤边界清楚,轮廓光整,占位效应不明显,较大病灶对 周围组织呈推移改变。良性病灶 MRI 检查密度及信号均 匀,体部病灶低于肌肉组织,肿瘤内部可见条状高信号, T1 加权成像(T1WI)呈低信号,扩散加权成像(DWI ) 序列呈低信号 [7] 。恶性病灶边缘呈分叶状,部分为多发病 灶,侵及相邻肌肉、骨骼等组织。较大病灶、恶性病灶密 度及信号不均匀,可见囊变坏死区。增强扫描病灶强化方 式多样,有报道表明,由于肿瘤内的病理组成成分不同所 致,但大部分均为中度或明显强化,强化主要与致密胶 原纤维和细胞致密区、囊变或黏液样变情况有关 [8] 。动态 增强扫描对于肿物的定性具有明显的帮助,动脉期多呈轻 度- 重度强化,静脉期持续强化,呈典型的“地图样”强 化,本病例中可见与之相符的强化方式。
3.4 病理特征 SFT 的诊断主要依赖 HE 染色病理形态观 察及免疫组织化学染色。典型 SFT 由椭圆形至梭形细胞核 的细胞组成,核异型性少,核分裂象少,具有分支的、薄 壁的鹿角形血管和突出的基质胶原蛋白,可伴有脂肪生 成、局部或广泛的黏液样改变或多核巨细胞 [9] ;恶性 SFT 具有多形性和更多核分裂象,可见血管外皮细胞瘤样结 构 [10]。免疫组织化学主要将抗原与抗体特异性结合,通过 化学反应使标记抗体显示(棕褐色颗粒),确定组织细胞 内抗原(多肽和蛋白质)。90% 以上的 SFT 具有特征性的 神经生长因子诱导基因 A 结合蛋白 2(NAB2 )-STAT6 融 合,该融合产物是由 12q13 基因倒位引起的,免疫组织化 学中细胞核表达 STAT6 是 SFT高度敏感和特异的标志物; 多数瘤细胞 CD34 全阳性表达,恶性和去分化 SFT 的 CD34、BCL2 染色减弱,CK 可能全阳性表达 [11];Ki-67 是 一种存在于增殖细胞内的核抗原,表达因细胞周期而异, G1 期出现,S 期与 G2 期逐渐增加,M 期达到最高值,分裂 后期表达锐减,不存在静止细胞,因此 Ki-67 可作为评估 肿瘤细胞增殖活性的客观指标,为判断预后提供依据。王 开金等 [12] 研究报道显示,肺原发 SFT 病理组织中 Ki-67 免疫组织化学学染色显示, Ki-67 阳性表达约 2%,与本研 究中结肠韧带 SFT 结果(3%+)相似。该病例 STAT6 和 CD34 弥漫阳性且 STAT6 是 SFT 的高度敏感性和特异性 标记物, SALL-4、CD117、S-100 阴性结合镜下形态排除 了间质瘤、生殖细胞肿瘤及脂肪肿瘤, Ki-67 增殖指数低 (3%+),支持SFT。
3.5 治疗和预后 该病例肿瘤体积较大,无相应临床症 状、体征及血液学指标改变,故多数发现较晚。另外由于 该病罕见,相关的影像学特征报道较少,故该病例价值在 于超声检查能够明确肿块的大小、边界、位置,以及与周 边组织的关系、血流信号等,指导手术方式的选择和评估 术后的复发率。该病例通过手术完整切除肿瘤,结合术后病理及免疫组织化学结果,确诊 SFT。
4 总结与展望
基于这一病例的诊疗思考,SFT 的最终诊断主要依靠 组织病理学,免疫组织化学可以提高诊断准确率。目前认 为手术完整切除肿瘤是最主要的治疗手段,SFT 的组织形 态学特征不能完全用于预测预后,该类肿瘤均具有复发和 远处转移的风险,因此术后应密切长期随访。但本研究不 足在于选取样本量仅为 1 例患者,有待扩大样本量,增加 良恶性 SFT 的对比研究,完善随访工作。
参考文献
[1] 王翠芝 , 周小鸽 , 黄受方 , 等 . 组织芯片在免疫组化染色阳性对 照中的应用 [J]. 临床与实验病理学杂志 , 2006, 22(4): 481-484.
[2] 汪洁 , 刘斌 , 李莉 , 等 . 孤立性纤维性肿瘤影像学表现及与 Ki-67表达的相关性 [J]. 安徽医科大学学报 , 2017, 52(5): 777-779.
[3] KALLEN M E, HOMICK J L. The 2020 WHO classification: what’s new in soft tissue tumor pathology?[J]. Am J Surg Pathol, 2021,45(1): e1-e23.
[4] SMRKE A, THWAY K, H HUANG P, et al. Solitary fibrous tumor: molecular hallmarks and treatment for a rare sarcoma[J]. Future Oncol, 2021, 17(27): 3627-3636.
[5] GHOLAMI S, CASSIDY M R, KIRANEA, et al. Size and location are the most important risk factors for malignant behavior in resected solitary fibrous tumors[J]. Ann Surg Oncol, 2017, 24(13): 3865-3871.
[6] 周盛 , 齐青 , 韩红 , 等 . 孤立性纤维性肿瘤的超声表现 : 附 10 例 报告 [J]. 中国临床医学 , 2014, 21(5): 575-577.
[7] 王海亮 , 阮圆 , 邬秀琴 , 等 . 腹盆腔孤立性纤维瘤的 MDCT/MRI 表现 [J]. 医学影像学杂志 , 2020, 30(5): 913-916.
[8] 秦涛 , 刘良进 , 曾艳妮 , 等 . 胸腹部孤立性纤维性肿瘤 CT 和MRI 影像学特征及诊断价值 [J]. 中国 CT 和 MRI 杂志 , 2021, 19(2):56-58.
[9] HUANG S C, HUANG HY. Solitary fibrous tumor: an evolving and unifying entity with unsettled issues[J]. Histol Histopathol, 2019,34(4): 313-334.
[10] GOLD J S, ANTONESCU C R, HAJDU C, et al. Clinicopathologiccorrelates of solitary fibrous tumors[J]. Cancer, 2002, 94(4): 1057-1068.
[11] SALAS S, RESSEGUIER N, BLAY JY, et al. Prediction of local and metastatic recurrence in solitary fibrous tumor: construction of a risk calculator in a multicenter cohort from the French Sarcoma Group (FSG) database[J]. Ann Oncol, 2017, 28(8): 1979-1987.
[12] 王开金 , 张春梅 , 王茜 . 以右肺巨大包块合并胸腔积液为主要表 现的肺原发孤立性纤维性肿瘤 1 例及文献复习 [J]. 中国组织化 学与细胞化学杂志 , 2022, 31(5): 493-497.
关注SCI论文创作发表,寻求SCI论文修改润色、SCI论文代发表等服务支撑,请锁定SCI论文网!
文章出自SCI论文网转载请注明出处:https://www.lunwensci.com/yixuelunwen/74726.html