SCI论文(www.lunwensci.com):
摘要:埃坡霉素是一类由纤维堆囊菌产生的抗肿瘤活性大环内酯类化合物,是目前备受关注的新型抗癌药物的先导物之一。本文对其天然 产生菌的遗传改造、基因工程菌的构建及其营养调控进行了综述,为埃坡霉素家族化合物的产量提升提供线索,为更多此品种的新药应用 奠定基础。
关键词:埃坡霉素;粘细菌堆囊菌;遗传改造;异源表达;营养调控
本文引用格式:易志恒,丁小军,罗晓红,等.埃坡霉素生物合成的遗传改造及营养调控[J].世界最新医学信息文摘,2019,19(30):48-50.
0引言
埃坡霉素(epothilones)是一类由纤维堆囊菌(Sorangium cellulosum )产生的16元大环内酯类化合物,具有显著的抗 肿瘤活性,其作用机制与目前被广泛应用的抗癌药物紫杉醇 (Taxol®)类似,可抑制微管蛋白二聚体解聚,将癌细胞的有丝分 裂过程破坏、诱导癌细胞的凋亡。与紫杉醇化学结构相比,天然 埃坡霉素的化学结构简单,水溶性更好,并且对耐紫杉醇的癌细 胞也表现出较强的抑制活性,产生的毒副作用也少,目前已有多 种埃坡霉素的衍生物被应用于临床研究.因此,天然埃坡霉素作 为母体化合物和先导物对开发埃坡霉素类抗癌新药具有非常重 要的意义。
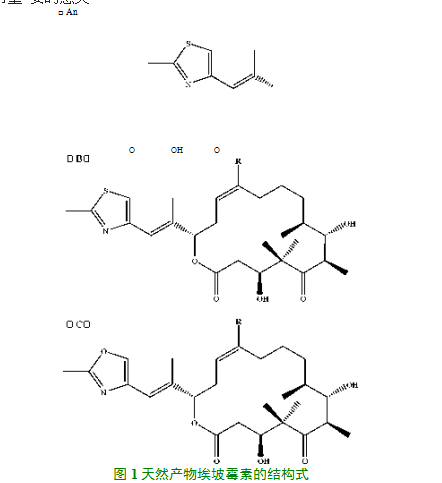
R为-H,埃坡霉素A;R为-CH
3,埃坡霉素B;R为-H,埃 坡霉素C;R为-CH3,埃坡霉素D;R为H],埃坡霉素;日为《玦, 埃坡霉素H
2
天然发酵产生的埃坡霉素家族化合物种类繁多,Hardt,et al 对粘细菌纤维堆囊菌So ce90发酵时的代谢产物检测,发现除了 含量相对多的埃坡霉素A
〜F(图1所示),埃坡霉素家族的35种其他结构类似物也被检测到。其中埃坡霉素C、D和12,13 -脱 氧埃坡霉素的产量略高(每升约3-6毫克),而其他成分如C21- 羟基的埃坡霉素衍生物和埃坡霉素E、F的产量都较低(每升约 1至100微克)。野生菌合成的埃坡霉素主体成为是A和B,它们是由埃坡霉 素C、D在单加氧酶的催化下形成的环氧化衍生物,其经羟基化 可以形成埃坡霉素E和F。埃坡霉素合成酶基因簇已被全部测 序,且已有报道证实埃坡霉素A
〜F的合成都来自同一个代谢途 径
o Gerth et al研究表明埃坡霉素家族化合物的大环内脂骨架 中的碳原子,均来源于短链脂肪酸盐或氨基酸,如乙酸盐,它在 菌种胞内是丙二酰辅酶A的形式(缩写为mCoA );而丙酸盐则 以甲基丙二酰辅酶A的形式存在(缩写为mmCoA );提供甲基 的是S-腺苷甲硫氨酸;半胱氨酸能提供给埃坡霉素硫和氮两 种原子。埃坡霉素家族化合物在细胞内的合成起过程,首先是 半胱氨酸和丙二酰辅酶A组合形成一个噻唑环,埃坡霉素A和 B的合成酶基因簇中,基因簇C模块编码的第二个酰基转移酶 对所需底物有选择性差异,埃坡霉素A合成时此转移酶选择结 合了 mCoA,当选择性地结合了底物mmCoA时,生成化合物埃 坡霉素B。
通过分析埃坡霉素家族化合物的生物合成途径基本可以推 测出来一条线索,即化合物母核的分子组装是由一个基因簇编 辑的复合体多酶来共同完成的,而该多酶复合体的模块A、B、C、 D、E、F负责了合成过程中埃坡霉素分子结构里所对应碳链的组 装。很多实验证明了,几乎所有的基因簇模块以及它们的结构 域,组成了埃坡霉素化合物的生物合成基因簇这是一个由PKS/ NRPS杂合的基因簇
,具体包括epoA、epoB、epoC、epoD、epoE、 epoF之内的6个模块。
天然产生埃坡霉素所用的菌种纤维堆囊菌的生长代时特别 长,野生菌长达16小时,而且特别易聚团生长,其传质和供氧缓 慢,不利于开展工业化快速发酵生产埃坡霉素。大家通过菌种的 理化定向选育、遗传改造等办法来培育高产埃坡霉素的工业菌 株,或构建高产埃坡霉素家族化合物的基因工程菌,或者对埃坡 霉素相关的生物合成过程进行环境条件优化和营养条件调控, 这些研究内容均成为生物医药工程领域的科技人员所关注的焦 点。本文则对这些能够提升埃坡霉素家族化合物产量的研究方 法进行了综述,为埃坡霉素家族化合物的应用和工业化生产提 供了思路。
1传统手段改造埃坡霉素天然产生菌
1.1采用紫外诱变的方法进行改造
紫外线诱变是生物育种科技人员首选的诱变技术手段,紫外 诱变通过多轮次长期累积,常可以叠加获得具有优良目标性状 的诱变子。由于纤维堆囊菌有胞外多糖且有堆积特性、代时长, 难以受紫外诱变。所以选育该类菌株的研究中一般不将紫外诱 变技术来单独使用,而是常常和其它选育手段相配合,作为育 种的基础工作为后续实验提供正突变的出发菌株。例如,Guoli Gong et al利用了多轮次紫外诱变的方法并配合上了适当的筛选 压力定向筛选,获得了高产埃坡霉素的目标菌株,它高于出发菌 株0.5
〜2.5倍的埃坡霉素产量,更重要的是为后续的实验工作中 能够开展原生质体融合,提供了一些可供选择的亲本菌株。
1.2采用化学诱变的方法进行改造
除紫外线方便作为诱变剂之外,还有传统的化学类的诱变 剂,例如,硫酸二乙酯、亚硝基胍是两种常被用于菌株的诱变选 育,称为化学诱变。例如孟凡欣和刘少斌实验过程中,曾经才用 硫酸二乙酯分别对埃坡霉素原始产生菌纤维堆囊菌DES35以及 ATCC15384,在紫外诱变的基础上的突变株进行了化学诱变,使 埃坡霉素家族化合物的总产量,前一个菌株提高了 0.34倍,后一 个菌株提高了5倍。再如,罗立新等采用了化学诱变剂亚硝基 胍对埃坡霉素菌株DSM11999进行了诱变,经过实验获得了家 族化合物中埃坡霉素A的产量比出发菌株DSM11999分别高出 0.3和0.4 mg/L的两株诱变菌种。
1.3原生质体融合进行基因洗牌
基因组洗牌(Genome shuffling)可以快速集中优良性状,作为 新型育种技术近年来大量应用。Genome shuffling技术是先通过 传统的诱变方法获得大量遗传性状已经突变的菌株,作为出发菌 株,从这些突变子中加以不同形状的压力筛选到出一些具有正突 变的突变子,以这些正向突变株作为下一轮次育种的亲本菌株, 然后开展多轮次的原生质体融合,突变子中的优良形状基因在基 因组水平上随机重组交换,最终通过将筛选压力逐步增加,获得 目标性状大幅改良的Genome shuffling融合子菌株。例如龚国利 等改良了常用的Genome shuffling技术,并且成功应用选育出了 能够高产埃坡霉素B的两株纤维堆囊菌菌株,使发酵液中埃坡霉 素B的HPLC检测产量分别达到了每升41.2毫克以及42.5毫克。
2基因工程手段构建工程菌
2.1异源前体合成酶的基因重组
德国国家生物技术中心的Gerth et. al通过大量实验证实 明了
,甲基丙二酰辅酶A,即methylmalonyl-CoA,是化合物埃坡 霉素B的生物合成过程所需的前体单元之一,甲基丙二酰辅酶 A又来源于丙酰辅酶A,丙酰辅酶A的转化过程是受到了丙酰 辅酶A合成酶的催化反应。通过提高丙酰辅酶A合成酶基因 (prpE)在纤维堆囊菌中表达量,则会加大埃坡霉素B合成量,并 且与埃坡霉素A比例有所增大。Han et al研究表明了如果将青 枯雷尔氏菌(Ralstonia solanacearum)的prpE基因,导入到埃坡 霉素B的原始产生菌纤维堆囊菌的基因组中,构建出来一种强 化丙酰辅酶A合成酶基因(prpE)的工程菌株,最终实现了选择 性的高产埃坡霉素B,而且实验结果表明化合物埃坡霉素B和 A的产量比例发生了变化,从野生菌株的2.5:1提高到了 127:1。 因此,针对纤维堆囊菌可以采用导入埃坡霉素前体相关的合成 酶基因而进行异源表达过程的强化,从而进一步选择性调节埃 坡霉素家族化合物中不同产品的种类比例和总产量。
2.2在链霉菌中的表达埃坡霉素
天蓝色链霉菌(Streptomyces coelicolor)是一种模式菌,它 含有体积较小的n型pks基因簇系统,是聚酮化合物的进行异 源表达所采用的常用宿主。Tang et al将纤维堆囊菌SMP44的 埃坡霉素编码基因簇几乎全部克隆了出来,并将该基因簇导入 了天蓝色链霉菌CH999中,进行埃坡霉素A和B的异源表达。 尽管采用基因工程手段构建的工程菌的生长速率比野生型纤维 堆囊菌生长速率的快10倍左右,但最终发酵液中化合物埃坡霉 素A和B的产量却极低,每升发酵液约50-100微克,比原始纤 维堆囊菌的低了约100倍,并且埃坡霉素对宿主天蓝色链霉菌 有较强的毒性,只要发酵体系中生成了少量的埃坡霉素,可能就 会杀死所使用的异源宿主。
委内瑞拉链霉菌(Streptomyces lividans )是另外选择的宿主 菌,它生长较为迅速、营养来源广泛、分子操纵素材齐全、遗传改 造相对简单,常用于合成14元大环内酯类的一些化合物,如苦 霉素(pikromycin ),所以委内瑞拉链霉菌也是生物合成聚酮类化 合物常用的异源宿主。Sung RP. et al将委内瑞拉链霉菌苦霉素 固有的聚酮合酶(polyketide synthase)基因敲除之后,将纤维堆 囊菌So ce9 0中的埃坡霉素家族化合物的全部合成基因簇导入 到了委内瑞拉链霉菌中,埃坡霉素B是在该发酵液中检测到的 主要目标产物,每升发酵液的埃坡霉素B产量约0.1微克。把埃 坡霉素合成基因簇敲除编码P450环氧化酶基因的epoF模块, 埃坡霉素D则在宿主中选择性的表达,这是相对活性较强的先 导化合物,每升发酵液中埃坡霉素D产量约0.4微克。如果再继 续导入正调控基因pikD,埃坡霉素D主产物的产量约提高1倍。 但转座基因(transport genes ) orf3和orf14在表达埃坡霉素D的 委内瑞拉链霉菌中敲除,将导致合成埃坡霉素D的量降低。
2.3埃坡霉素合成基因在大肠杆菌中的表达
2006年Kosan研究团队尝试在大肠杆菌中进行埃坡霉素 母核化合物。大肠杆菌遗传背景非常清晰、生长迅速且能高密 度发酵、易于进行遗传修饰操作,是优良的异源表达的宿主。 Kosan研究团队首先基因设计并合成获得了编码埃坡霉素的6 个。RFs片段,通过密码子优化,含有了优先适宜大肠杆菌的遗 传密码子和限制性酶切位点,长约50 kb的埃坡霉素合成基因簇 组装成功了,将其克隆到大肠杆菌中。但是大肠杆菌一般自身 表达的蛋白分子据报道最大只有155 kDa左右,但是埃坡霉素等 聚酮化物的合成基因蛋白分子达到800 kDa以上,这为聚酮化物 合成基因在大肠杆菌中的表达带来了极大困难。由于合成埃坡 霉素家族化合物的PKS蛋白在大肠杆菌的溶解度又有限,初始 异源表达工作非常困难。但大肠杆菌作为异源宿主,具有生长 快等其它菌株无可比拟的一些优越性,该模式菌株也被广泛用 于表达聚酮化合物的宿主,例如有报道已成功表达了 6-脱氧红 霉内酯B以及耶尔森杆菌素等代表性的聚酮类化合物。
Kosan研究小组进一步通过启动子替换和分子伴侣共表达 等多种方案进行了表达优化,埃坡霉素相关基因簇所编码的可 溶性的蛋白被表达了,目标化合物埃坡霉素C和D也最终表达 出了。由于大肠杆菌只能表达epoD、E、F基因,通过提供EpoD 蛋白合成所需的活性硫酯前体,则诱导了目标化合物埃坡霉素C 和D的生物合成。实验结果表明采用生物计算机设计优化,并 按照优化设计在体外合成埃坡霉素的基因簇,再通过大肠杆菌 表达该基因簇,可以为聚酮合酶(PKS)的生化研究和生物合成 新的埃坡霉素家族类似物提供一个理想的技术平台。但是也由 于最终报道的发酵液埃坡霉素表达量较低,只有每升0.01微克, 大肠杆菌这样的宿主还是难以用于埃坡霉素异源表达生产。
2.4埃坡霉素基因在黄色粘球菌中表达
粘细菌中另一种常用的模式菌株是黄色粘球菌(Myxococcus. xanthus ),其遗传背景清楚、代时短(只有5小时)。黄色粘球菌 与纤维堆囊菌有着较为亲近的种属关系,但黄色粘球菌的生长速 度比纤维堆囊菌将近快3倍,且在基因工程操作中并不需要引入 新的启动子。例如Kosan研究在黄色粘球菌异源表达埃坡霉素 过程中,将埃坡霉素的合成基因簇拆分成两部分,其中一段65.4 kb,然后通过一系列的同源重组,这段65.4 kb的埃坡霉素基因簇 被成功地插入到了黄色粘球菌基因组中,最终发酵液中检测到黄 色粘球菌工程菌异源表达埃坡霉素总产量只有每升0.16毫克。 引入一个编码P450酶的epoK的突变基因插入该基因工程菌株 中,可以成功表达出埃坡霉素C和D但产量也非常低。
将不同修饰度的埃坡霉素PKS合成基因簇导入到黄色粘 球菌中,一些结构新颖的埃坡霉素类似物能够表达出。例如将 epoPKS模块6中的KR结构域失活,异源表达之后的基因工 程菌主产物是9-氧代埃坡霉素D,以及其同分异构体8-epi- 9-氧代埃坡霉素D。修饰模块4中的KR结构域可以微量表达 12,13-二氢-13-氧代埃坡霉素C,但11,12-去氢-12,13-二 氢-13-氧代埃坡霉素D却成为了主要表达家族组化合物类型, 但并没有表达出12,13-二氢-13-氧代埃坡霉素D。分析13- 氧代埃坡霉素家族化合物的异源表达结果表明,PKS合成基因 簇模块5中ER结构域修饰是具有底物特异性的。
3生物合成埃坡霉素的营养调控
纤维堆囊菌作为粘细菌中非常特殊的一个属,其野生菌的生 理生化需求特异性非常明显,不同的野生纤维堆囊菌菌株表现 出对同种营养物质的特异性利用程度不同,菌株合成不同种类 和数量的次级代谢产物而且会受到培养基中不同的营养成分的 诱导。因此通过优化培养条件和营养调控,可以获得埃坡霉素 家族化合物的种类和产量变化。
3.1调控碳源和氮源合成埃坡霉素
作为快速碳源,大多菌种可以普遍利用的是葡萄糖,根据Gerth et al的研究结果显表明示,碳源葡萄糖对不同的纤维堆囊菌菌株的 生长,以及合成埃坡霉素家族化合物类型和产量会产生不用影响。 例如纤维堆囊菌So ce1198会因为葡萄糖的浓度增大而抑制埃坡霉 素家族化合物的合成,纤维堆囊菌So ce90菌株将随着葡萄糖的浓 度增大造成合成的埃坡霉素家族化合物的量会随之增加。
例如罗立新等人研究纤维堆囊菌DSM11999的营养调控时 发现,如果分别将马铃薯淀粉和胰蛋白胨为合成埃坡霉素的碳 氮源,该菌株合成埃坡霉素总量达最大。
3.2调节无机盐来调控合成埃坡霉素
无机盐中的铵盐和磷酸盐是常用的调控因素,他们含量增 加会将纤维堆囊菌发酵合成埃坡霉素家族化合物水平抑制。美 国Kosan公司人员的研究比较了两个菌种:一个是纤维堆囊菌So ce90,另一个是基因工程菌 M. xanthus ATCC PTA-2712(K111-40- 1),二者在发酵合成埃坡霉素时,受到发酵培养基中铵盐和磷酸盐 的抑制程度有所不同,例如12 mM的铵离子浓度会使基因工程菌 PTA-2712只降低40%的产量,而So ce90埃坡霉素家族化合物的 产量降低90%;当磷酸根离子在5 mM时,So ce90和PTA-2712埃 坡霉素产量均降低60%,当磷酸根离子浓度增大时,基因工程菌 PTA-2712受影响程度没有变化,当磷酸根离子浓度在17 mM时, So ce90将受到严重影响,发酵合成埃坡霉素产量降低95%。
3.3通过调节前体物质改变埃坡霉素合成
在不同时间添加不同种类、数量的前体物质,次级代谢产物 的代谢量会产生改变。Frykman等人的研究报道,对于抗癌化合 物埃坡霉素母核的合成前体乙酸盐和丙酸盐,如果添加这两种前 体到基因工程菌M. xanthus K111-40-1的发酵培养基中,埃坡霉 素D和C的产量比例会受添加方式变化的影响。增加二碳单位 乙酸盐可以使埃坡霉素D和C的比例减小,而添加丙酸盐,埃坡 霉素D和C比例会先增大再减小。L-丝氨酸和乙酸盐或丙酸盐 分别添加时,含有恶唑环的埃坡霉素H
i和玦是K111-40-1菌 株的主要合成产物(图1(C)),埃坡霉素D和C的产量也大幅降 低,菌株K111-40-1中恶唑单元的生物合成受到了底物的限制。
3.4通过生长因子及微量元素进行调控
微生物的繁殖代谢常受到生长因子及微量元素的影响。 Kosan公司的研究发现,优化发酵生产埃坡霉素时,铁元素加量 到20 ^M可以使纤维堆囊菌So ce90的合成埃坡霉素的产量达 到最大,基因工程菌M. xanthus ATCC PTA-2712也有类似规律。 甲基丙二酰变位酶的辅因子V
B12也参与埃坡霉素的合成代谢。 Frykman et al研究发现,添加Vg至K111-40-1中,随浓度不断 增加时,埃坡霉素D和C的比例有呈现一个规律是先增大后减小。
罗立新等人的研究表明,纤维堆囊菌DSM11999发酵过程中 调控生长因子及少量的微量元素,可以使埃坡霉素的产量提高 约 22.5%。
3.5调控溶解氧来影响埃坡霉素的合成
P450单氧酶可以将埃坡霉素代谢途径的中间产物转化为终 产物,在发酵过程中,细胞色素P450单氧酶的酶活性受到溶解氧 的影响,通过限制溶解氧浓度可以使其活性降低,而酶活性降低 则会积累这些中间产物。Frykman的研究了通过限制溶解氧对埃 坡霉素产量的影响。基因重组菌株黄色粘球菌M. xanthus K111- 40-1发酵生产埃坡霉素时,在过量溶解氧的情况下,合成埃坡霉 素A和B为主,当溶解氧不足,生物合成埃坡霉素化合物C和D 为主。在溶解氧贫瘠的情况下,比在溶解氧过量的条件下菌体密 度的峰值会高出60%,而溶解氧过量时,发酵产生新的埃坡霉素 家族化合物的黄色粘球菌K111-40-1中由EpoK模块催化而合 成了 10,11-二去氢-埃坡霉素B,足以看到溶解氧的调控作用。
4结论
纤维堆囊菌野生型菌株因为生长缓慢,传质供氧等收到聚 团生长等特性的限制而造成埃坡霉素产量较低,使得其工业化 生产极富挑战性。为了解决该问题,国内外很多研究团队通过 采用不同育种技术手段,从多个角度对埃坡霉素产生菌纤维堆 囊菌进行了遗传改造,如本文综述的紫外诱变、化学诱变、改良 Genome shuffling以及基因重组等,均获得了埃坡霉素产量有一一 定提升的相对优良的菌株。但是由于纤维堆囊菌的特殊生长特 性,以及埃坡霉素合成基因簇的复杂,改良后的生产菌株产量仍 然不满足工业大生产的需要。
异源表达是相对有效的手段,改善纤维堆囊菌生长特性和 提升埃坡霉素产量最有潜力,改造埃坡霉素的生物合成基因簇、 寻找优良的异源宿主成为研究者们努力的方向。链霉菌、粘球 菌、大肠杆菌已被作为异源宿主成功表达出了埃坡霉素家族化 合物。然而至今还未有高表达埃坡霉素的异源宿主适合工业化 应用。对埃坡霉素合成基因簇来讲,异源表达系统应该有利于 聚酮化合物合成酶的催化特性的发挥,且必须可以表达相对较 大的聚酮蛋白,并能对这些蛋白进行后期翻译和修饰,以及可以 产生足够的细胞内的合成元件,比如丙二酰-CoA和甲基丙二 酰-CoA等。据报道
,枯草芽孢杆菌(Bacillus subtilis )、费氏链 霉菌(Streptomyces fradiae、、糖多孢红霉菌(Saccharopolyspora eythraea )以及酿酒酵母(Saccharomyces cerevisiae )
[37]都成功表 达过聚酮化合物,将来可以作为埃坡霉素的异源宿主进行尝试。
营养成份在次级代谢产物合成调控中起重要作用。对埃坡 霉素的产生菌进行营养调控可以改善埃坡霉素家族化合物的产 量,还可以改变埃坡霉素家族化合物的种类,甚至发现新的埃坡 霉素结构类似物。但营养调控只是对埃坡霉素产生菌条件的优 化有一定的限度,只能是改善埃坡霉素产量的一种辅助手段。
通过采用遗传改良、异源表达及营养调控多重应用,可改善 微生物天然产物的代谢。利用这些传统方法改善埃坡霉素家族 化合物产量有一定的成效,但要能满足工业化生产埃坡霉素的 要求,仍需要寻找新路径。
参考文献
[1] Shimkets L, Dworkin M, Reichenbach H. The myxobacteria[A] // Dworkin M. The Prokaryotes[M]. 3rd ed. Berlin: Springer, 2006:31-115.
[2] Brenner DJ, Krieg NR, Staley JT. The Proteobacteria (Part C): the Alpha-, Beta-, Delta-,and Epsilonproteobacteria[A] // Garrity GM. Bergey s Manual of Systematic Bacteriology[M]. 2nd ed. New York: Springer, 2005: 1059-1144.
[3] Hardt IH, Steinmetz H, Gerth K, et al. New Natural Epothilones from Sorangium cellulosum, Strains So ce90/B2 and So ce90/D13: Isolation, Structure Elucidation, and SAR Studies^. J Nat Prod,2001,64: 847.
[4] Gerth K, Steinmetz H, Hofle G, Reichenbach H. Studies on the Biosynthesis of Epothilones: Hydroxylation of Epo A and B to Epothilones E and FJ]. J Antibiot,2002,55: 41-45.
[5] Schneiker S,Perlova O,Kaiser O,et al.Complete genome sequence of the myxobacterium Sorangium cellulosum[J].Nature Biotechnology, 2007,25(11):1281-1289.
[6] 李亚伟,影响埃博霉素生物合成的竞争性微生物筛选与分析[D].齐鲁 工业大学硕士论文,2013.
关注SCI论文创作发表,寻求SCI论文修改润色、SCI论文代发表等服务支撑,请锁定SCI论文网!
文章出自SCI论文网转载请注明出处:https://www.lunwensci.com/yixuelunwen/5213.html