SCI论文(www.lunwensci.com):
摘要:目的观察大黄素对脂多糖诱导的人牙周膜细胞增殖及炎症因子表达的影响。方法采用LPS以最佳浓度诱导人牙周膜细胞,建立牙周炎细胞模型,同时加入大黄素进行干预。实验分为3组:空白对照组、模型组、大黄素干预组;7d后,通过倒置相差显微镜、CCK-8法、流式细胞术分别检测各组细胞形态学、增殖及周期的变化,炎性因子。结果与空白对照组相比,脂多糖诱导的人牙周膜细胞具有明显的增殖作用;与空白对照组相比,模型组细胞生长速度加快,G1期的细胞比例降低,S期细胞的比例升高;与模型组相比,大黄素干预组细胞增殖减慢,G0/G1期比例升高,S期比例降低。结论脂多糖诱导的人牙周膜细胞形态、增殖特性发生异常改变;大黄素可抑制牙周膜细胞在炎性微环境中的生物学特性的变化,为临床防治牙周炎提供实验依据。
关键词:大黄素;脂多糖;人牙周膜细胞
本文引用格式:喜鹏.大黄素对脂多糖诱导的人牙周膜细胞增殖和周期的影响[J].世界最新医学信息文摘,2019,19(98):275-277.
Effects of Emodin on Proliferation and Cell Cycle of Human Periodontal Ligament Cells Induced by Lipopolysaccharide
XI Peng
(Dingxi Second People's Hospital of Gansu Province,Dingxi Gansu)
ABSTRACT:Objective To observe the effect of astragaloside(AS)on LPS-induced proliferation of human periodontal ligament cells and expression of inflammatory factors.Methods LPS was used to induce human periodontal ligament cells at the optimal concentration.A periodontal inflammatory cell model was established and AS was added to intervene.The experiment was divided into 3 groups:blank control group,model group,and AS intervention group.After 7 days,the morphology,proliferation and cycle of cells were detected by inverted phase contrast microscopy,CCK-8,and flow cytometry,respectively.factor.Results Compared with the blank control group,lipopolysaccharide could significantly promote the proliferation of human periodontal ligament cells.Compared with the blank control group,the growth rate of the model group increased,the proportion of G1 phase decreased,and the proportion of S phase increased;Compared with the AS intervention group,the proliferation of cells was slowed down,the proportion of G0/G1 phase increased,and the proportion of S phase decreased.Conclusion The lipopolysaccharide induces abnormal changes in cell morphology and proliferation characteristics of human periodontal ligament cells.AS can inhibit the changes of biological characteristics of periodontal ligament cells in the inflammatory microenvironment and provide experimental basis for clinical pre-vention and treatment of periodontitis.
KEY WORDS:Astragaloside A;Lipopolysaccharide;Human periodontal ligament cells
0引言
牙周炎(Periodontitis)作为当前威胁人类口腔健康的两大慢性疾病之一,是由病原体及其代谢产物,其中以通过脂多糖(Lipopolysaccharide,LPS)的刺激而诱导的持续性炎症免疫反应,最终可引起局部牙周支持组织的破坏,是牙齿松动和脱落的一个主要原因[1]。当前,并无针对牙周病的特异性的治疗药物,因此牙周炎的治疗依然处于基础治疗加药物治疗的阶段,还有部分通过牙周手术治疗等,不仅治疗周期长,而且预后不佳,因此非常有必要寻找一种安全有效的药物。有报道称[2],大黄素对于治疗牙周炎效果较佳,不仅可以有效的降低牙周组织内的炎症因子水平,还可以促进牙周组织再生。本研究通过LPS刺激人牙周膜细胞来建立牙周炎细胞模型,通过体内实验进一步探讨大黄素对LPS诱导的人牙周膜细胞的保护作用,同时旨在为防治牙周炎提供新疗法。
1材料和方法
1.1实验药物
大黄素,购自源叶生物公司(批号:C10J6Y1,纯度≥90%),将40mg大黄素粉末溶于50mL MSCM培养基中,超净台内经0.22μm微孔滤器过滤,使大黄素药液终浓度为0.8mg/mL,4℃保存,用时按照工作液浓度进行稀释。
1.2细胞株
人牙周膜细胞株,购自美国ScienCell公司(编号:7500)。
1.3试剂
胎牛血清(Wisent公司,批号:086150021);DMEM(500mL)(HyClone公司,批号:7501);0.25%胰蛋白酶(Hyclone公司,批号:J150037);CCK-8试剂盒(Biosharp公司,批号:1214BS165)。
1.4仪器
全自动细胞荧光计数分析仪(美国CELLOMETER公司,AUTO X4);酶标仪(美国BIO-RAD公司,IMARK);倒置相差显微镜(日本OLYMPUS公司,IX81);二氧化碳培养箱(日本三洋电机公司,MCO-18AIC)。
1.5方法
人牙周膜细胞采用DMEM培养基培养,将其置于37℃、5%CO2的孵育箱中培养。每隔2、3d换液一次,直至细胞汇合度约达80%后,0.25%胰蛋白酶对其消化传代,第3代细胞用于实验。
1.5.1大黄素的最佳浓度
本实验选用Gupta V团队[3]筛选的大黄素最佳浓度作用于人牙周膜细胞,采用大黄素浓度为40μg/mL。
1.5.2牙周炎细胞模型建立及分组
取第3代的人牙周膜细胞,按照2×104个/孔的细胞数接种于六孔板内,采用浓度为100ug/mL的LPS诱导72h,每天观察细胞。分组包括:空白对照组、模型组、大黄素干预组。各组分别连续诱导72h,每48h换液一次,同时添加LPS和大黄素以维持其最佳浓度。72h之后,将细胞进行传代,连续培养。采用倒置显微镜来观察各组的细胞形态直至形态发生变化,进行拍照记录,之后进行相关指标的检测。
1.5.2.1细胞形态观察
每天将各组细胞置于显微镜下进行形态观察,直至形态出现典型变化时采集图像。
1.5.2.2CCK-8法检测各组细胞增殖能力
收集生长对数期状态良好的人牙周膜细胞,胰酶消化后制成单细胞悬液,用细胞计数仪进行计数并调整细胞浓度,种植于96孔板(2×103个/孔),每孔接种量为200μL,边缘孔用200μL无菌磷酸盐缓冲液填充,置于5%CO2、37℃饱和湿度细胞培养箱中继续培养,每48h进行一次换液。接种细胞后分别在第24h、48、72、96、120、144、168小时时采取CCK-8法进行各组细胞吸光值的检测。将CCK-8溶液加入到待测孔中,放回培养箱中继续培养4 h。将待测的96孔板取出,用酶标仪读取450 nm波长处的各组细胞吸光度OD值。重复3次实验,取平均值,并绘制细胞生长曲线图。
1.6.1.1流式细胞术(FCM)检测各组细胞周期
收集对数期的各组细胞,调整密度至2×106个/mL,移至1.5mL EP管内,PBS缓冲液洗涤1~2次,1000rpm,离心3min;弃上清,加入预冷的70%乙醇,轻轻吹打混匀后,4℃过夜固定;次日将固定的细胞1000rpm,离心5min;弃上清,加入预冷的500μL PBS缓冲液并重悬细胞;50μg/mL的PI染液(含50μg/mL的R Nase),室温避光孵育30min,流式细胞仪检测,计算G1期及S期细胞比例。重复实验3次。
1.6.1.2统计学分析
应用SPSS 21.0统计软件分析。结果采用均数±标准差(x±s)表示,多组间均数的比较采用one-way ANOVA;两组间的比较采用Student's t test,P<0.05为差异有统计学意义。
2结果
2.1各组细胞形态观察
LPS诱导人牙周膜细胞42h,同时给予AS干预,并在培养42h后置于倒置显微镜下观察细胞形态,发现正常对照组人牙周膜细胞为长梭形、星性,排列整齐,呈现旋涡状生长;模型组人牙周膜细胞排列紊乱、成团簇状生长、呈现一定的异型性;大黄素干预组细胞为成纤维样,排列较整齐,分布较均匀(图1)。
2.2AS对炎性微环境中人牙周膜细胞增殖的影响
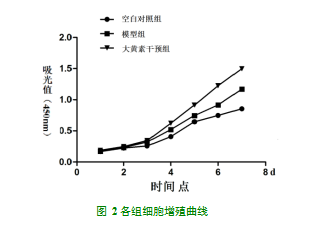
用CCK-8法定量分析AS对LPS诱导的人牙周膜细胞增殖情况并绘制增殖曲线,与正常BMSCs组比较,模型组在第3、4、5、6、7天,细胞生长速度明显加快,差异有统计学意义(P<0.05);与模型组比较,大黄素干预组组在第4、5、6、7天,细胞生长速度明显减慢,差异有统计学意义(P<0.05)(表1和图2)。
2.3各组细胞流式周期结果观察
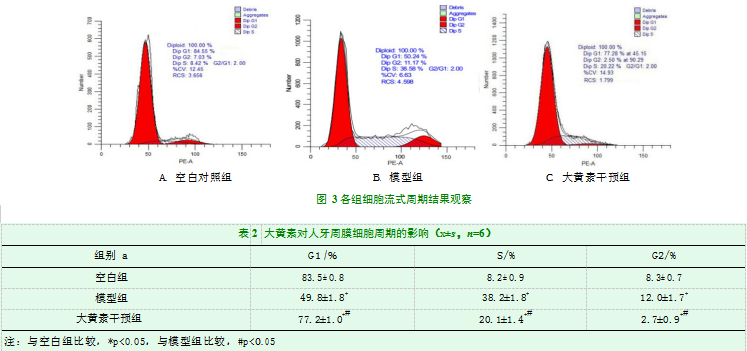
各组细胞周期变化结果见表2及图3。细胞周期检测显示,与正常对照组相比,模型组细胞G1期比例显著降低,S期的细胞比例显著升高,差异有统计学意义(P<0.05)。与模型组比较,大黄素干预组细胞G1期比例升高,S期的细胞比例下降,差异有统计学意义(P<0.05)。
3讨论
目前,牙周炎是口腔的较为常见的疾病,反复多发,患者口腔主要的病理改变是牙周袋形成以及牙槽骨吸收,严重者可直接引起牙松动甚至脱落,临床治疗时是通过修复口腔内破坏的牙周组织,重新构建牙周新附着,近年来,诸多的国内外的实验研究对牙周炎疾病的治疗进行了报道[4]。研究指出,多种细胞的增殖、迁移和分化在牙周组织的再生、修复和重建过程中发挥至关重要的作用。其中,牙周膜细胞含多种异质性细胞群,主要是由成骨细胞、成纤维细胞、成牙骨质细胞及未分化的间充质细胞等构成[5],在体外矿化诱导培养时,牙周膜细胞能够形成矿化结节,这一过程与成骨细胞极其相似,表明牙周膜细胞中的骨向分化亚群与未分化间充质细胞通过增殖分化成为牙槽骨与牙骨质,对于牙周的创伤修复与组织的再生过程尤为重要[6,7]。
我国中药资源丰富,多取材于天然的动植物及矿物,与西药相比具有毒副作用小,取材广泛,易提取,临床疗效明显等优点。研究表明,大黄素在治疗牙周疾病的治疗与预防中被广泛应用,其治疗效果显著。据研究结果统计,大黄素是许多植物的根和皮中天然存在的蒽醌,同时也是大黄的重要活性成分。杜建东团队研究大黄素干预牙周炎大鼠的牙周组织中骨钙素(bone gla protein,BGP)、白介素6(Interleukin 6,IL-6)水平的变化,通过该实验的研究结果表明,大黄素能够抗菌消炎,同时具有免疫调节、促进骨形成的重要作用[8]。王国芳等[9]通过将大黄素注射给牙周炎模型大鼠,采用光学显微镜观察其牙周组织的病理学变化,并测量釉牙本质界至牙槽嵴顶的距离,细胞计数仪检测破骨细胞数,实验发现,大黄素可抑制牙周炎模型大鼠的牙槽骨吸收。刘冰等人[10]研究大黄素不同浓度下对于牙周炎模型的大鼠的治疗效果,实验结果指出,大黄素可显著降低牙槽骨的吸收,使得牙周附着丧失,同时还能够促进牙槽骨的形成,其治疗效果与大黄素的浓度呈正相关。本实验结果显示:与空白组相比较,模型组牙周细胞的排列紊乱,呈现团簇状的生长,同时可见一定程度的异型性。通过检测牙周膜细胞的增殖,发现模型组的生长速度显著加快。牙周膜细胞的周期结果提示,模型组的G1期细胞比例最低,S期细胞比例最高。而经过大黄素干预后,牙周膜细胞生长速度显著减慢,同时发现,干预后的G1期细胞比例显著升高,S期细胞比例明显下降。这些结果表明大黄素可能通过抑制牙周膜细胞增殖,最终达到预防与治疗牙周炎的效果。这与相关文献[11-12]报道是相一致的。
综上,大黄素能够有效地抑制牙周膜细胞的增殖,这可能有益于牙周炎患者的恢复与愈合,同时为治疗牙周病开辟一条新的道路。另外,由于牙周膜细胞虽然来源相同,但是其细胞结构和功能不完全相同。因此,大黄素在治疗不同细胞亚群时,调控的机制、发挥作用以及用药的方式等方面还需我们进一步地深入研究。
参考文献
[1]Hanai H,Iida T,Takeuchi K,et al.Curcumin maintenance therapy for ulcera-tive colitis:randomized,multicenter,double-blind,placebo-controlled tri-al[J].Clinical Gastroenterology&Hepatology,2006,4(12):1502-1506.
[2]刘延丰.大黄素温敏凝胶治疗急性智齿冠周炎的临床观察[J].吉林医学,2017,38(10):1884-1885.
[3]Gupta V,Saggu S,Tulsawani RK,et al.A dose dependent adaptogenic and safety evaluation of Rhodiola imbricate Edgew,a high altitude rhizome[J].Food Chem Toxicol,2008,46(5):1645-1652.
[4]Mombelli A,Gmür R,Lang NP,et al.Actinobacillus actino-mycetemcomitans in Chinese adults.Serotype distribution and analysis of the leukotoxin gene promoter locus[J].J Clin Periodontol,1999,26(8):505-510.
[5]唐亮,金岩.影响牙周膜干细胞功能的重要因素[J].实用口腔医学杂志,2009,25(5):737-740.
[6]Chadipiralla K,Ji M Y,Bahuleyan B,et al.Osteogenic differentiation of stem cells derived from human periodontal ligaments and pulp of human exfo-liated deciduous teeth[J].Cell&Tissue Research,2010,340(2):323-333.
[7]Washio K,Iwata T,Mizutani M,et al.Assessment of cell sheets derived from human periodontal ligament cells:a pre-clinical study[J].Cell&Tissue Re-search,2010,341(3):397-404.
[8]杜建东,余占海,何福德.大黄素对牙周炎大鼠牙周组织中骨钙素白细胞介素6表达的影响[J].临床医学,2009,(1):92-97.
[9]王国芳,吴织芬,万玲,等.三种中药提取物抑制牙周炎牙槽骨吸收的实验研究[J].临床口腔医学杂志,2005,21(6):325-327.
[10]刘冰,李淑娟,杨冬茹,等.大黄素治疗实验性牙周炎的骨计量学研究[J].实用口腔医学杂志,2010,26(5):593-596.
[11]谭学东,黎淑芳,朱晓莹,等.五倍子联合黄芩提取物复合液对牙周膜细胞增殖和周期的影响[J].中国药业,2018(8):975-978.
[12]许彦枝,杨凤英,罗冬青.中药双黄补对体外培养人牙周膜细胞增殖活性的影响[J].中国组织工程研究,2009,13(37):7341-7345.
关注SCI论文创作发表,寻求SCI论文修改润色、SCI论文代发表等服务支撑,请锁定SCI论文网! 文章出自SCI论文网转载请注明出处:https://www.lunwensci.com/yixuelunwen/25657.html