SCI论文(www.lunwensci.com):
摘要:目的探讨外源性H2S对大肠癌细胞增殖及凋亡的影响并研究其机制。方法用NaHS作为H2S的供体,大肠癌LOVO细胞株作为细胞模型,采用MTT比色法法及流式细胞仪分别检测大肠癌细胞增殖抑制率和凋亡情况,Western blot检测Akt蛋白的表达情况。结果0.1及1.0mM NaHS时间和浓度依耐性的增加大肠癌细胞的增殖抑制率和凋亡,并能下调Akt蛋白的表达。而Akt激动剂IGF-1能逆转NaHS诱导大肠癌细胞增殖抑制率和凋亡的增加。结论H2S通过抑制Akt蛋白的表达,下调PI3K/Akt信号通路,从而抑制大肠癌细胞的增殖,促进其凋亡。
关键词:硫化氢;PI3K/Akt信号通路;大肠癌细胞
本文引用格式:唐吉平,陆海娟,林丙,等.外源性H2S通过PI3K/Akt信号通路促进大肠癌细胞的凋亡[J].世界最新医学信息文摘,2019,19(93):36-38.
Exogenous H2S Promotes the Apoptosis of Colorectal Cancer Cells through the PI3K/Akt Signaling Pathway
TANG Ji-ping1*,LU Hai-juan2 LIN Bing1 JIA Xin-ju1 SU Ting1
(1.The second Nanning people’s hospital ICU,Nanning Guangxi;2.GuangXi tumor hospital nutritional department,Nanning Guangxi)
ABSTRACT:Objective To investigate the effect of exogenous H2S on proliferation and apoptosis of colorectal cancer LOVO cells,and to study its mechanism.Methods Using NaHS as the H2S donor,colorectal cancer LOVO cell as a cell model,using MTT method to measure the cell proliferation inhibition rate,apoptosis was detected by flow cytometer,the expression of Akt protein was detected by Western blot.Results The 0.1 and 1.0mM NaHS promote the proliferation inhibition and apoptosis of colon cancer cells,and down regulate the expression of Akt protein.While this effects were reverse by the Akt agonist IGF-1.Conclusion H2S can inhibit the proliferation and promote apoptosis in colon cancer cells;and its mechanism may be related to down-regulation of Akt protein expression,inhibiting PI3K/Akt signal transduction pathway.
KEY WORDS::Hydrogen sulfide;PI3K/Akt signal pathway;Colorectal cancer LOVO cells
0引言
大肠癌是结肠癌和直肠癌的总称,它是指大肠黏膜上皮细胞发生的恶性肿瘤,是消化道常见恶性肿瘤之一,也是近二十、三十年来发病率增长最快的癌症之一[1]。其预后不良,五年生存率低,死亡率较高,严重威胁人类的身体健康和身心健康,对社会医疗带来沉重的负担。目前,尚无有效的方法能完全根治大肠癌,因此,寻找新的有效的抗癌药物治疗大肠癌具有十分重要的意义。H2S是被认为是继NO和CO后的第3类气体信号分子[2],它广泛分布在机体的各个组织和器官中。在哺乳动物体内中能够自然合成,参与机体内多种生理、病理过程。最新的研究表面,在多种肿瘤的发生和发展的病理过程中,H2S发挥着重要作用,并且能调节肿瘤细胞的增殖和凋亡[3]。磷脂酰肌醇3-激酶/蛋白激酶B(PI3K/Akt)蛋白家族参与细胞增殖、分化和凋亡等多种细胞功能的调节[4],研究显示:PI3K/Akt活性的增加常与多种癌症相关[5]。H2S能否通过PI3K/Akt通路参与调节大肠癌细胞的增殖及凋亡?基于以上问题,本实验采用人大肠癌细胞体外培养模型,以NaHS为外源性H2S的供体,观察H2S对大肠癌细胞的增殖和凋亡的影响,并进一步探讨其机制是否与PI3K/Akt信号通路有关,为临床上治疗及治愈大肠癌提供一条新的方向及新的的思路。
1材料与方法
1.1材料
硫氢化钠(Sodium hydrosulfide,NaHS)、胰蛋白酶、PI3K/Akt激动剂IGF-1(Sigma),MTT(Sigma公司,美国);DMEM(GIBCO公司,美国)、小牛血清(杭州四季青公司);兔抗人p-Akt单克隆抗体(Epitomics),辣根酶标记二抗(Sigma)。DAB辣根过氧化物酶显色试剂盒(北京艾然生物科技有限公司),流式细胞仪(美国BD公司),全自动酶标仪(ELX-800,Bio-Tek,USA)。
1.2方法
1.2.1细胞培养
将快速复温的大肠癌LOVO细胞株接种于含10%小牛血清的DMEM培养液中,将培养箱培养温度设置为37℃,CO2饱和度为5%,待细胞传代至细胞稳定生长至对数生长期,按照试验设计分组方案及处理方案将细胞接种至96孔培养板中,加入不同浓度的NaHS,每组试验细胞重复5孔。
1.2.2MTT比色法检查细胞增殖情况
细胞接种于96孔培养板后在37℃、5%CO2饱和度培养箱培养过夜后,按试验分组要求给以不同浓度的NaHS及IGF-1。分别培养12、24和48小时后,每孔加0.5%MTT 20L,继续培养4小时,去培养液,加二甲基亚砜100L,置摇床上低速震荡10分钟,用酶联免疫仪测量各孔波长570 nm和630mm双波长的吸光值(OD值)。根据OD值计算细胞增殖率,细胞增殖抑制率(%)=(对照组A值-观察组OD值/对照组OD值)×100%。
1.2.3流式细胞术检测大肠癌细胞凋亡
大肠癌细胞以浓度为5×105/mL接种于96孔培养板后,细胞接种于96孔培养板后,按试验分组要求给以不同浓度的NaHS以及IGF-1。在37℃、5%CO2饱和度培养箱培养,培养至试验设计的时间后收集细胞,在低温环境中用PBS缓冲液清洗2次(1000rpm离心5分钟),离心制成细胞悬液,然后加入2l RNA酶(0.25mg/mL)再加入5l Annexin V-FITC和5l的50mg/L的PI溶液,混匀。室温下避光染色30 min。流式细胞仪检测染色细胞数及总细胞数,并计算细胞凋亡率。
1.2.4免疫印迹法(Western Blot)法检测Akt蛋白水平
细胞以10×105/mL密度平均接种于细胞培养瓶中,在37℃、5%CO2孵育箱中培养。加入不同不同处理因素继续孵育至所需时间。收集各组细胞,用温的PBS液冲洗3遍,后加入预冷的蛋白裂解液1mL冰浴裂解30 min,10000 rpm离心10 min,取上清,使用BCA法蛋白定量后将所有样本调至等浓度备用。按厂家的实用指南配制好分离胶和积层胶后,细胞样品加入上样缓冲液后,100℃煮5 min,然后每孔加入20g细胞蛋白样品,置于电泳缓冲液中,以初始电压为45V的电流强度进行温流电泳,当电压达到65V该改为稳压电泳,电泳分离蛋白后,取下目标含有目标蛋白的胶,在半干式电转膜仪上以10V电压半干式转膜30min将目标蛋白质转移至PVDF膜。TBS液清洗3次。用5%脱脂牛奶封闭液封闭2h后,加一抗兔抗人p-Akt(1:1000,β-actin(1:1000)抗体,4℃孵育过夜。洗膜后再加入加入二抗(1:2000),37℃孵育2h。再次洗膜3次,再暗室中加AP-NBT/BICP发光剂于PVDF膜上激发荧光后,实用胶片显影定影,胶片实用Image J 1.37v软件进行灰度扫描进行分析。
1.3统计分析
使用SPSS 18.0软件对试验数据进行统计分析,所有观察指标用平均数±标准误(Means±SEM)表示,采用One-way ANOVA方差分析,LSD-t检验,以P<0.05判定差异有无统计学意义。
2结果
2.1H2S抑制大肠癌细胞的增殖
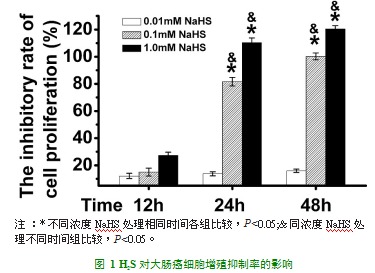
为了明确H2S对大肠癌细胞增殖的影响,我们采用MTT比色法检查大肠癌细胞的增殖抑制率,如图1所示,0.1mM NaHS处理24h组与相同浓度的NaHS处理12h或0.01mM NaHS处理24h组相比,细胞增殖抑制率明显增高(P<0.05);0.1mM NaHS处理48h组与相同浓度的NaHS处理12h或0.01mM NaHS处理48h组相比,细胞增殖抑制率明显增高(P<0.05);1.0mM NaHS处理24h组与相同浓度的NaHS处理12h或0.01mM NaHS处理24h组相比,细胞增殖抑制率明显增高(P<0.05);1.0mM NaHS处理48h组与相同浓度的NaHS处理12h或0.01mM NaHS处理48h组相比,细胞增殖抑制率明显增高(P<0.05)并且这种效应具有时间和浓度依耐性。
2.2H2S促进大肠癌细胞的凋亡
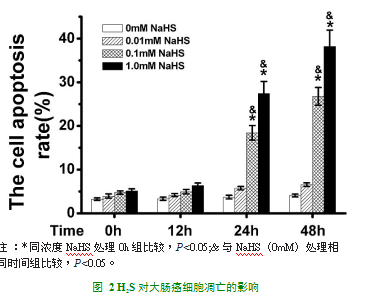
为进一步探讨H2S对大肠癌细胞的影响,我们采用流式细胞术检测各组大肠癌细胞凋亡情况,如图2所示:0.1mM NaHS处理组的细胞凋亡率随处理时间的增长而增加(P<0.05);1.0 mM NaHS处理组的细胞凋亡率随处理时间的增长而增加(P<0.05),并且这种作用具有浓度依赖性(P<0.05)。
2.3H2S抑制大肠癌细胞的Akt的表达
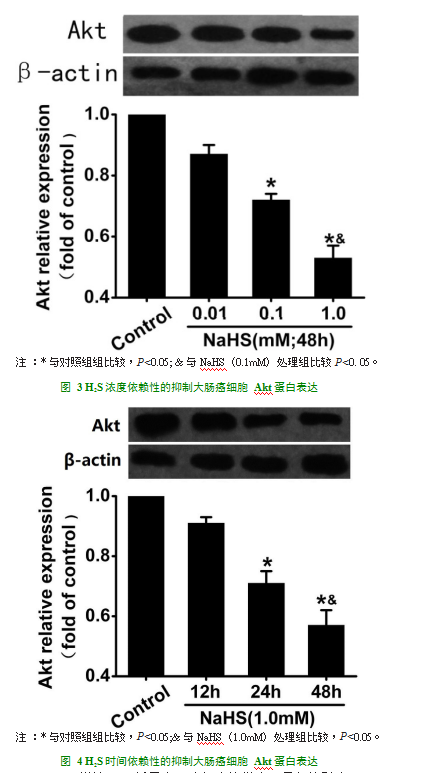
我们采用Western Blot法检测各组Akt蛋白的表达,如图3所示:加入不同浓度的NaHS处理48h后,0.1mM NaHS处理与对照组相比,Akt蛋白的表达明显下降(P<0.05);1.0mM NaHS处理与对照组或0.01mM处理组相比,Akt蛋白的表达明显下降(P<0.05),说明NaHS能浓度依赖性的下调大肠癌细胞Akt蛋白的表达。如图4所示:1.0mM NaHS处理24h组与对照组相比,Akt蛋白的表达明显下降(P<0.05);1.0mM NaHS处理48h组与对照组或与相同浓度的NaHS处理12h相比,Akt蛋白的表达显著下调(P<0.05)。说明NaHS能时间依赖性的抑制大肠癌细胞Akt蛋白的表达。
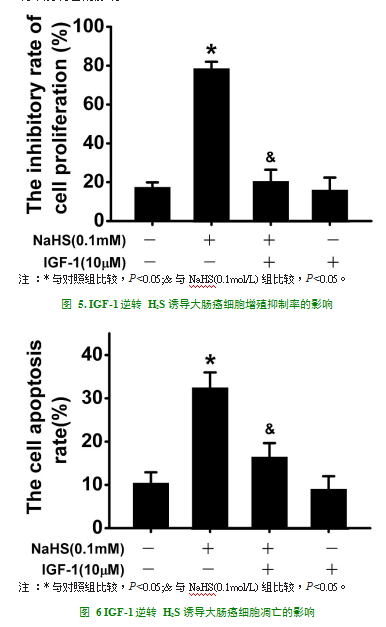
2.4IGF-1逆转H2S诱导大肠癌细胞的增殖及凋亡的影响
为了明确H2S对大肠癌细胞增殖及凋亡的影响是否跟PI3K-Akt通路有关,我们使用IGF-1作为PI3K/Akt信号通路激动剂,探讨IGF-1对H2S诱导大肠癌细胞的增殖及凋亡的影响,如图5所示:0.1mM NaHS处理大肠癌细胞24h,细胞增殖抑制率明显增加(P<0.05),而NaHS与IGF-1共同处理组与对照组相比,细胞增殖抑制率增加不明显。如图6所示:0.1mM NaHS处理大肠癌细胞24h,细胞凋亡率明显增加(P<0.05),而NaHS与IGF-1共同处理组与对照组相比,细胞凋亡率增加不明显。说明PI3K/Akt信号通路激动剂IGF-1能逆转逆转H2S诱导大肠癌细胞增殖抑制率及凋亡的影响。
3讨论
大肠癌是消化道常见恶性肿瘤之一,也是近二三十年来发病率增长最快的癌症之一[1]。其预后不良,五年生存率低,死亡率较高,严重威胁人类的身体健康和身心健康,对社会医疗带来沉重的负担,已经成为严重的社会问题。目前随着大肠癌手术的改进、化疗药物及化疗方案的不断改进,大肠癌患者的5年生存率仍然较低。因此,寻找新的有效地化疗药物,是目前提高大肠癌患者生存率的关键。
H2S是一种具有臭鸡蛋臭味的有毒气体,近年来被认为是继CO和NO之后的第3中气体信号分子[2],研究表明,在哺乳动物机体中能内源性地合成H2S,它在胱硫醚-β-合成酶(cystathionine-β-synthase,CBS)和/或胱硫醚-γ-裂解酶(cystathionine-γ-lyase,CSE)的催化下以同型半胱氨酸和/或半胱氨酸为底物催化生成[6]。H2S具有多方面的生物学效应,参与机体内多种生理及病理过程[7]。最近的体外实验研究表明:外源性H2S(NaHS为供体)可以启动肝癌细胞凋亡机制诱导肝癌细胞凋亡[8]。我们的实验结果显示:外源性H2S能抑制大肠癌细胞的增殖,促进大肠癌细胞的凋亡,这种效应还具有浓度和时间依耐性。表明H2S有望成为大肠癌新的有效的化疗药物。
磷脂酰肌醇3-激酶(PI3K)蛋白家族参与细胞增殖、分化及凋亡等多种细胞功能的调节,PI3K活性的增加有多种癌症有关。丝氨酸/酸酸激酶(Akt)作为一种原癌基因,已经成为医学界主要的关注热点。近年来的研究发现PI3K和其下游信号分子Akt所组成的信号通路与人类肿瘤的发生密切相关[9]。PI3K通过与具有磷酸化酪氨酸残基的生长因子受体相互作用,引起二聚体构象改变而被激活,激活后的PI3K通过第二信使活化Akt,活化的Akt通过磷酸化作用激活或者抑制其下游的靶蛋白,进而调节细胞的增殖、分化、凋亡以及迁移[10]。此外,活化的Akt能够通过磷酸化FoxO蛋白以及Mum2蛋白,从而参与细胞调节细胞的凋亡[11]。AKT还能对凋亡信号通路上以及增殖信号通路的其他信号分子进行磷酸化参与调节细胞的增殖、分化及凋亡[11][12]。因此PI3K/AKT通路在肿瘤的发生发展中以及肿瘤防治中具有十分重要的意义。我们的实验结果显示:外源性H2S能浓度及时间依赖性降低Akt的蛋白表达。为明确H2S促进大肠癌细胞的凋亡是否跟H2S下调Akt蛋白表达有关,我们在NaHS处理的基础上再加用Akt受体激动剂IGF-1,结果显示:IG F-1逆转了NaHS诱导的大肠癌细胞增殖抑制率和凋亡的增加。因此,我们得出结论H2S可能通过下调Akt蛋白的表达,抑制PI3K/Akt信号转导通路,从而抑制大肠癌细胞的增殖,促进其凋亡。
本实验以NaHS作为H2S的供体,以大肠癌细胞作为恶性肿瘤细胞模型,在离体试验中研究了外源性H2S对恶性肿瘤细胞的抗增殖和促凋亡作用,为今后抗恶性肿瘤的药物研发及临床治疗恶性肿瘤提供了新的靶点和新的思路。
参考文献
[1]Abou Saleh M,Mansoor E,Anindo M.Prevalence of Small Intestine Carcinoid Tumors:A US Population-Based Study 2012-2017[J].Digestive diseases and sciences,2019,64(5):1328-1334.
[2]Predmore BL,Lefer DJ,Gojon G.Hydrogen sulfide in biochemistry and medicine[J].Antioxidants&redox signaling,2012,17(1):119-40.
[3]Hale VL,Jeraldo P,Mundy M.Synthesis of multi-omic data and community metabolic models reveals insights into the role of hydrogen sulfide in colon cancer[J].Methods(San Diego,Calif.),2018,149:59-68.
[4]Zhang HB,Lu P,Guo QY.Baicalein induces apoptosis in esophageal squamous cell carcinoma cells through modulation of the PI3K/Akt pathway[J].Oncology letters,2013,5(2):722-728.
[5]Zhang M,Sai B,Cao P.Iron Oxide Nanoparticles Synergize with Erlotinib to Suppress Refractory Non-Small Cell Lung Cancer Cell Proliferation Through the Inhibition of ErbB/PI3K/AKT and PTEN Activation[J].Journal of biomedical nanotechnology,2017,13(4):458-68.
[6]Cao X,Ding L,Xie ZZ.A Review of Hydrogen Sulfide Synthesis,Metabolism,and Measurement:Is Modulation of Hydrogen Sulfide a Novel Therapeutic for Cancer?[J].Antioxidants&redox signaling,2018.
[7]Singh SB,Lin HC.Hydrogen Sulfide in Physiology and Diseases of the Digestive Tract[J].Microorganisms,2015,3(4):866-89.
[8]Wang SS,Chen YH,Chen N.Hydrogen sulfide promotes autophagy of hepatocellular carcinoma cells through the PI3K/Akt/mTOR signaling pathway[J].Cell death&disease,2017,8(3):e2688.
[9]Chen J,Crawford R,Chen C.The key regulatory roles of the PI3K/Akt signaling pathway in the functionalities of mesenchymal stem cells and applications in tissue regeneration[J].Tissue engineering.Part B,Reviews,2013,19(6):516-28.
[10]Wang H,Zhang Q,Wen Q.Proline-rich Akt substrate of 40kDa(PRAS40):a novel downstream target of PI3k/Akt signaling pathway[J].Cellular signaling,2012,24(1):17-24.
[11]Wang S,Yan Y,Cheng Z.Sotetsuflavone suppresses invasion and metastasis in non-small-cell lung cancer A549 cells by reversing EMT via the TNF-α/NF-κB and PI3K/AKT signaling pathway[J].Cell death discovery,2018,4:26.
[12]Jafari M,Ghadami E,Dadkhah T.PI3k/AKT signaling pathway:Erythropoiesis and beyond[J].Journal of cellular physiology,2019,234(3):2373-2385.
关注SCI论文创作发表,寻求SCI论文修改润色、SCI论文代发表等服务支撑,请锁定SCI论文网! 文章出自SCI论文网转载请注明出处:https://www.lunwensci.com/yixuelunwen/24762.html