SCI论文(www.lunwensci.com):
摘要:目的探讨杨梅苷(Myricetin)对RANKL诱导的小鼠巨噬细胞RAW264.7向破骨细胞分化的影响。方法通过CCK-8法筛选出不同浓度(1.25mg/L、2.5mg/L、5mg/L、10mg/L、20mg/L)杨梅苷对RAW264.7细胞的毒性作用。分别用50μg/L的RANKL、50μg/L RANKL+1.25mg/L、2.5mg/L、5mg/L、10mg/L的杨梅苷诱导RAW264.7细胞5天。对形成的破骨细胞进行TRAP染色并计数,TRAP染色阳性且细胞核数目≥3个认为是成熟的破骨细胞。50μg/L的RANKL、50μg/L RANKL+1.25mg/L、10mg/L的杨梅苷培养RAW264.7细胞24小时,使用荧光实时定量PCR检测破骨细胞分化成熟相关基因C-Fos、NFATc1、Ctsk、TRAP的表达。结果1.25mg/L、2.5mg/L、5mg/L、10mg/L浓度的杨梅苷对RAW264.7细胞毒性较小,可作为后续实验的用药浓度。TRAP染色显示,1.25mg/L、2.5mg/L、5mg/L、10mg/L浓度的杨梅苷可以抑制RANKL诱导的成熟破骨细胞的数目,且呈剂量依赖关系。RT-PCR结果显示,1.25mg/L、10mg/L的杨梅苷可以抑制破骨细胞分化相关基因C-Fos、NFATc1、Ctsk、TRAP的表达,且10mg/L的抑制作用比1.25mg/L更为显著。结论杨梅苷对RAW264.7细胞毒性较低,通过下调相关基因的表达抑制RANKL诱导的RAW264.7细胞向破骨细胞分化。杨梅苷可作为治疗骨质破坏相关疾病的潜在药物。
关键词:杨梅苷;RANKL;破骨细胞;RAW264.7细胞
本文引用格式:王云龙,巩栋.杨梅苷抑制RANKL诱导的RAW264.7细胞分化为破骨细胞的研究[J].世界最新医学信息文摘,2019,19(66):14-17.
Myricetin Inhibits the Differentiation of RAW264.7 Cells Induced by RANKL into Osteoclasts
WANG Yun-long,GONG Dong
(Gansu University of Traditional Chinese Medicine,Lanzhou Gansu)
ABSTRACT:Objective To investigate the effect of myricetin on RANKL-induced murine macrophage RAW264.7 cells differentiation into osteoclasts.Methods The effects of different concentrations(1.25mg/L,2.5mg/L,5mg/L,10mg/L,20mg/L)of myricetin on the survival of RAW264.7 cells were determined by CCK-8 method.RAW264.7 cells were induced with 50μg/L RANKL,50μg/L RANKL+1.25 mg/L,2.5 mg/L,5 mg/L,10 mg/L of myricetin for 5 days,respectively.The formed osteoclasts were subjected to TRAP staining and counting,and TRAP staining was positive and the number and number of cells>3 were considered mature osteoclasts.50μg/L RANKL,50μg/L RANKL+1.25mg/L,10mg/L myricetin cultured RAW264.7 cells for 24 hours,using fluorescent real-time quantitative PCR to detect the expression of the osteoclast differentiation-related genes C-Fos,NFATc1,Ctsk and TRAP.Results Myricetin at concentrations of 1.25 mg/L,2.5 mg/L,5 mg/L,and 10 mg/L was less toxic to RAW264.7 cells and could be used as a concentration for subsequent experiments.TRAP staining showed that quercetin at concentrations of 1.25 mg/L,2.5 mg/L,5 mg/L,and 10 mg/L inhibited the number of mature osteoclasts induced by RANKL in a dose-dependent manner.RT-PCR results showed that 1.25 mg/L and 10 mg/L of myricetin could inhibit the expression of C-Fos,NFATc1,Ctsk and TRAP in osteoclast differentiation,and the inhibition of 10 mg/L was more significant than 1.25 mg/L.Conclusions Myricetin is less toxic to RAW264.7 cells and inhibits RANKL-induced osteoclast formation by down-regulating the expression of related genes.Myricetin can be used as a potential drug for the treatment of diseases related to bone destruction.
KEY WORDS:Myricetin;RANKL;Osteoclasts;RAW264.7 cells
0引言
骨骼在维持身体结构、肢体运动和稳定性方面发挥着重要作用,因此有必要始终保持骨骼系统的良好状态[1-2]。正常情况下,骨的重塑不断循环进行,这一过程涉及成骨细胞的骨形成和破骨细胞的骨吸收,通常情况下二者处于平衡状态。骨质疏松症、类风湿性关节炎和牙周疾病等骨质破坏性疾病是由于二者活动失衡引起的[3]。研究发现,许多骨质破坏性疾病均与破骨细胞活动亢进相关,因此近年来,越来越多的研究将破骨细胞作为骨质破坏性疾病研究的切入点,试图依此来找到治疗此类疾病的新途径。
骨重塑受巨噬细胞集落刺激因子(M-CSF),核因子-κB配体受体激活剂(RANKL)以及RANK的控制。破骨细胞的形成亦由M-CSF和RANKL介导,这一过程包括破骨前体细胞的成熟以及相互融合成为多核破骨细胞[4-6],这两种重要的细胞因子可由成骨细胞分泌。M-CSF与破骨前体细胞上的c-fms受体结合并刺激其增殖和存活,而RANKL与其受体RANK结合,启动破骨前体细胞分化并相互融合成成熟的破骨细胞[7]。RANKL与RANK的偶联结合引发下游信号通路的激活,特别是NF-κB的激活,是多核破骨细胞形成和存活的关键调节因子[7]。
RAW264.7被认为是一种破骨前体细胞,通过诱导可获得大量、成熟的破骨细胞,该细胞可表达破骨细胞表型标志的基因,是目前公认的唯一成体系的破骨前体细胞[8]。在其表面有核因子-κB受体活化因子(RANK),自身还能够分泌诱导破骨细胞所必须的巨噬细胞集落刺激因子(M-CSF)[9],因此只需在体外培养体系中加入核因子-κB受体活化因子配体(RANKL)就可将RAW264.7细胞诱导为成熟的破骨细胞。
杨梅苷(myricitrin,五羟基黄酮-3-鼠李糖苷),为天然多酚羟基黄酮苷类化合物,广泛存在于杨梅科植物杨梅的树皮及树叶,豆科植物鬼箭锦鸡儿的枝叶,蓼科植物萹蓄的地上部分等[10,11]。具有改善微循环、抗炎、抗氧化及抑制细胞凋亡等多种生理、药理活性[12]。有研究显示杨梅苷可通过阻断MAPK/P38信号通路发挥抗炎镇痛的作用[13]。有研究已经证实,在骨质疏松等骨破坏性疾病中,破骨细胞活性亢进与炎性反应有紧密联系[14];在动物骨质疏松模型中,杨梅苷改善了绝经后骨质疏松小鼠松质骨的骨微结构,提高了这些小鼠的骨矿物质密度,起到了保护骨量的作用[15]。因此,作者推测杨梅苷可能具有抑制破骨细胞分化成熟的作用。本实验旨在探讨杨梅苷对RANKL诱导的破骨细胞分化成熟有何影响。
1材料与方法
1.1细胞株及试剂
RAW264.7细胞购自南京科佰生物。DMEM培养基、αMEM培养基、胎牛血清(fet al bovine serum,FBS)、青霉素-链霉素双抗(penicillin-streptomycin solution,PS)购自美国Hyclone公司。重组小鼠RANKL蛋白购自美国Peprotech公司。杨梅苷购自美国Selleck公司。抗酒石酸酸性磷酸酶(tartrate resistant acid phosphatase,TRAP)染色试剂盒购自美国Sigma公司。细胞毒性试剂(cell counting kit-8,CCK-8)购自日本Dojindo公司。PrimeScript逆转录试剂盒及SYBR Premix Ex Tap试剂盒购自日本TaKaRa公司。PCR引物由大连TaKaRa生物公司合成。
1.2细胞培养
RAW264.7细胞常规培养于DMEM完全培养基,含10%的胎牛血清及青链霉素双抗(链霉素100g/mL,青霉素100U/mL),培养箱条件为37℃含5%CO2。1-2天换液一次,细胞融合至70%-80%传代。
1.3细胞活性测定
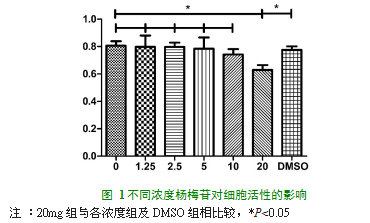
RAW264.7细胞消化后以2×104个/mL接种于96孔板,共分7组,每组3个复孔。8小时后细胞贴壁,弃掉原培养基加入杨梅苷终浓度为0、1.25、2.5、5、10、20mg/L及含0.1%DMSO的完全培养基,继续培养。24小时后将培养基更换为含10%CCK-8试剂的100L DMEM培养基,在37℃避光条件下孵育2小时。随后在15min内用酶标仪测定每孔450nm吸光值。通过下述公式计算细胞存活率:
1.4染色及观察成熟破骨细胞
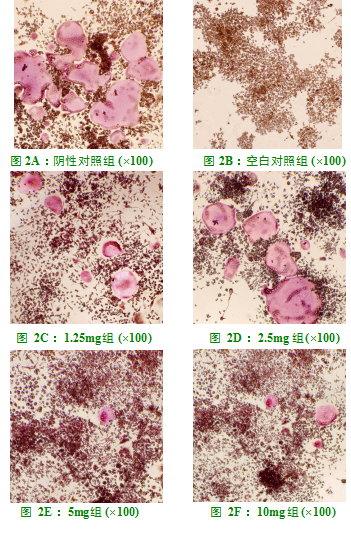
RAW264.7细胞消化好后以3×104个/mL接种于96孔板,共分5组,每组3个复孔。8小时后细胞贴壁,弃掉原培养基分别加入浓度为100ng/mL的RANKL且杨梅苷终浓度为0、1.25、2.5、5、10mg/L的完全培养基,于37℃、5%CO2环境下继续培养,每1-2天换液一次。5天后弃掉培养基,PBS液润洗细胞3遍,按TRAP染色试剂盒说明书进行TRAP染色。于光镜下观察,TRAP染色阳性且细胞核数目≥3个的多核细胞为成熟破骨细胞。各孔均取3个相同位置视野,用Image Pro Plus 6.0软件分析每孔成熟破骨细胞所占视野面积,取平均值,实验重复3遍。
1.5实时定量PCR检测
RAW264.7细胞消化好后以1×105个/mL接种于6孔板,共分4组,每组3个复孔。8小时后细胞贴壁,弃掉原培养基,空白组加入不含RANKL及杨梅苷的完全培养基,其余3组分别加入浓度为100ng/mL的RANKL且杨梅苷终浓度为0、1.25、10mg/L的完全培养基,于37℃、5%CO2环境下继续培养。24小时后弃掉培养基,使用Trizol提取总RNA,使用PrimeScript试剂盒按使用说明书反转录cDNA。PCR反映体系为20L,PCR反应条件见表1。基因引物序列见表2,以β-actin为内参,使用2-ΔΔCT法计算基因产物的相对值。
1.6统计学方法
所得实验结果以均数±标准差(±s)表示,采用软件SPSS20.0进行统计学分析。采用单因素(ANOVA)方差分析进行组间比较,方差齐性时,采用Fisher least significant difference(LSD)进行组间多重比较,方差不齐时,采用Dunnett T3进行组间多重比较,P<0.05为差异有统计学意义。
2结果
2.1杨梅苷对RAW264.7细胞活性的检测
细胞毒性实验显示,除20mg/L杨梅苷处理组外,1.25mg/L、2.5mg/L、5mg/L、10mg/L杨梅苷处理组及DMSO组与阴性对照组相比较,组间差异均无统计学意义(P>0.05),20mg/L组与各组相比较,在450nm处的吸光值差异均有统计学意义(P<0.05)。说明杨梅苷在1.25mg/L~10mg/L间对细胞毒性较小。
2.2TRAP染色结果
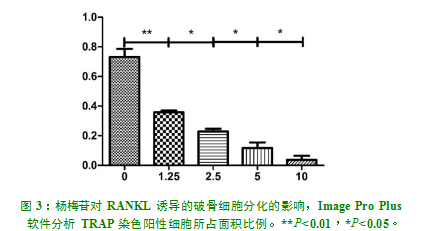
100ng/mL的RANKL刺激RAW264.7细胞5天后,可以诱导出成熟的破骨细胞(TRAP染色阳性,细胞核数≥3个)(图2A)。加入杨梅苷后,RAW264.7细胞向破骨细胞分化受到了显著抑制,成熟破骨细胞的数量、大小均逐渐减小(图2B-E)。1.25mg/L、2.5mg/L、5mg/L、10mg/L均可抑制RANKL诱导下破骨细胞的形成,且抑制程度呈剂量依赖性,各组间差异有统计学意义(P<0.05)(图3)。
2.3杨梅苷对破骨细胞相关基因表达的影响
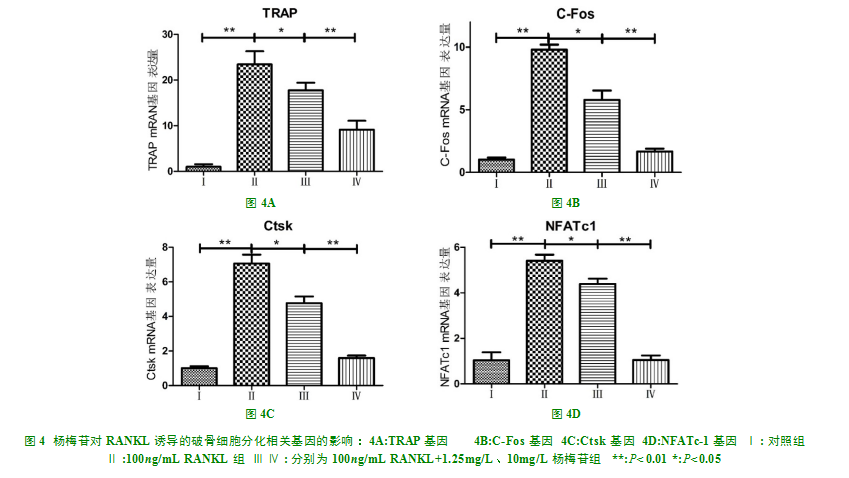
实时荧光定量PCR结果表明,RAW264.7细胞在RANKL的诱导下,破骨细胞相关基因(NFATc1、c-Fos、Ctsk、TRAP)的表达水平与阴性对照组相比较都出现了极显著性增加(P<0.01)。加入杨梅苷后,破骨细胞相关基因的表达受到抑制,低剂量组(RANKL+1.25mg/L)与空白对照组(RANKL)相比有显著性差异(P<0.05),高剂量组(RANKL+10mg/L)与低剂量组(RANKL+1.25mg/L)相比有极显著性差异(P<0.01)(图4)。
3讨论
骨质疏松症是一种全身性的骨代谢疾病,其特征是骨矿物质密度(BMD)降低,骨组织微结构恶化,骨脆性增加,导致人体骨折风险增加[16-17]。骨质疏松症分为两型,一种为绝经后妇女由于雌激素缺乏导致的骨量迅速减少,另一种为由于衰老导致的、病程缓慢的骨质疏松症[18]。异常的骨吸收在与年龄相关的骨质疏松症形成过程中非常常见,其发病机制系由骨量过度丢失引起[19]。
许多天然物质及其衍生物对于治疗疾病都有着潜在的价值。杨梅苷来源于杨梅科植物杨梅的树皮及树叶等,是一种天然化合物[10,11],可用于诸如抗炎、抗氧化、改善微循环、抑制细胞凋亡等多种用途[12]。然而很少有关于杨梅苷对于骨活性影响的机制、以及杨梅苷影响骨活性有效生物成分的相关文献报道。
小鼠单核巨噬细胞RAW264.7是用Abelson鼠白血病病毒诱导BALB/c小鼠产生肿瘤后,收集小鼠腹水单核巨噬细胞得到的细胞株,是目前公认的唯一成体系的破骨前体细胞[8],可被RANKL诱导为成熟的破骨细胞。RANKL属于肿瘤坏死因子受体(TNFR)家族成员,可由成骨细胞分泌,其表达受多种细胞因子和激素水平的调控[20]。RANKL与破骨前体细胞表面的RANK结合,启动前体细胞向破骨细胞分化、增殖,并促进破骨细胞的成熟。在实验中,我们首先测定了杨梅苷对于RAW264.7细胞活性的影响。根据CCK-8实验结果显示,杨梅苷浓度在1.25-10mg/L对细胞活性无明显影响,20mg/L则可以显著抑制细胞活性。在杨梅苷抑制破骨细胞分化的实验中,我们观察到杨梅苷可以显著抑制RANKL诱导的破骨细胞分化,且抑制效果与杨梅苷浓度呈依赖关系,结合CCK-8实验结果,可以排除这一抑制效果是由于杨梅苷对细胞的毒性作用而导致的。
RANKL与破骨前体细胞表面RANK结合后最终引起一系列的信号级联反应。NFATc1、c-Fos是破骨细胞分化的重要转录因子,他们的激活引起下游破骨细胞分化相关标志基因的表达。其中NFATc1通过控制破骨细胞相关基因,在调节破骨细胞分化进程中扮演着主要角色,而c-Fos是诱导NFATc1活化的重要因子[21]。因此我们检测了杨梅苷对C-Fos/NFATc1基因表达的影响。我们发现杨梅苷可以显著抑制C-Fos/NFATc1基因在RANKL诱导的破骨细胞中的表达。在破骨细胞分化的最后阶段,NFATc1扮演着最末梢的转录因子来调节破骨细胞相关基因的表达如:Ctsk、TRAP等。组织蛋白酶K(CtsK)的过量表达可以导致骨量的丢失[22-23]。在本研究中,杨梅苷可以降低由RANKL诱导的破骨细胞CtsK基因的表达。TRAP是一种铁结合蛋白,其在原代破骨细胞中及诱导的破骨细胞分化过程中高度表达[24]。在我们的研究中,杨梅苷亦可以抑制由RANKL诱导的破骨细胞TRAP基因的表达。
综上,本实验发现,杨梅苷可以抑制由RANKL诱导的RAW264.7细胞向成熟破骨细胞的分化。实验结果表明,杨梅苷对细胞的毒性较低,即使较高的高浓度对细胞活性亦无明显影响;杨梅苷可以抑制破骨细胞的分化成熟,且抑制程度与杨梅苷剂量呈依赖关系;杨梅苷可以抑制C-Fos/NFATc1等破骨细胞分化关键基因的表达,同样可以抑制破骨细胞关键酶的基因如:Ctsk、TRAP等基因的表达。本实验在细胞水平上支持杨梅苷对破骨细胞具有抑制作用,为杨梅苷作为骨质疏松症辅助治疗的研究提供了部分实验支持。
参考文献
[1]Boyce B F,Xing L.Functions of RANKL/RANK/OPG in bone modeling and remodeling[J].Biochem.Biophys,2008,473(2):139-146.
[2]Rodan G A,Martin T J.Therapeutic approaches to bone diseases[J].Science.2000,289(5484):1508-1514.
[3]Walsh M C,Kim N,Kadono Y,et al.OSTEOIMMUNOLOGY:interplay between the immune system and bone metabolism[J].Immunol,2006,24(4):33-63.
[4]Nakashima T,Hayashi M,Fukunaga T,Kurata K,et al.Evidence for osteocyte regulation of bone homeostasis through RANKL expression[J].Nat.Med,2011,17(11):1231-1234.
[5]Souza P P C,Lerner U H.The role of cytokines in inflammatory bone loss[J].Immunol,2013,42(9),555-622.
[6]Xiong J,Onal M,Jilka R L,et al.Matrix-embedded cells control osteoclast formation[J].Nat.Med,2011,17(9):1235-1241.
[7]Cappariello A,Maurizi A,Veeriah V,et al.Reprint of:The Great Beauty of the osteoclast[J].Biochem.Biophys,2014,561(11),13-21.
[8]Yamamoto A,Miyazaki T,Kadono Y,et al.Possible involvement of IkappaB kinase 2 and MKK7 in osteoclastogenesis induced by receptor activator of nuclear factor kappaB ligand[J].Bone Miner Res,2002,17(4):612-621.
[9]Shadduck R K,Waheed A,Mangan K F,etc.Preparation of a monoclonal antibody directed against the receptor for murine colony-stimulating factor-1[J].Exp Hematol,1993,21(4):515-520.
[10]廖华卫,刘恩桂,王定勇.杨梅树皮的化学成分研究[J].中南药学,2006,03:196-199.
[11]刘志国,张予川,吉双,等.杨梅树皮化学成分的分离与鉴定[J].沈阳药科大学学报,2010(01):34-36.
[12]Domitrovic R,Rashed K,Cvijanovic O,et al.Myricitrin exhibits antioxidant,anti-inflammatory and antifibrotic activity in carbon tetrachloride-intoxicated mice[J].Chem Biol Interact,2015,230:21-29.
[13]Meotti F C,Posser T,Missau F C,etc.Involvement of p38MAPK on the antinociceptive action of myricitrin in mice[J].Biochem Pharmacol,2007,74(6):924-931.
[14]Qin M,Luo Y,Meng X B,etc.Myricitrin attenuates endothelial cell apoptosis to prevent atherosclerosis:An insight into PI3K/Akt activation and STAT3 signaling pathways[J].Vascul Pharmacol,2015,70:23-34.
[15]Qiang Huang,Bo Gao,Long Wang,etc.Protective effects of myricitrin against osteoporosis via reducing reactive oxygen species and bone-resorbing cytokines[J].Toxicology and Applied Pharmacology,2014,280(3):550-560.
[16]Jee WS,Yao W.Overview:animal models of osteopenia and osteoporosis[J]. J.Musculoskelet.Neuronal Interact,2001,1(3):193-207.
[17]Weitzmann MN.The role of inflammatory cytokines,the RANKL/OPG Axis,and the immunoskelet al interface in physiological bone turnover and osteoporosis[J].Sci.Tech.Rep,2013:1-29.
[18]Kahn A,Gibbons R,Perkins S,et al.Age-related bone loss:a hypothesis and initial assessment in mice[J].Clin.Orthop.Relat.Res,1995,313:69-75.
[19]Cummings S R,Melton L J.Epidemiology and outcomes of osteoporotic fractures[J].Lancet,2002,359(9319):1761-1767.
[20]Brien EA,Williams JH,Marshall MJ.Osteoprotegerin is produced when prostaglandin synthesis is inhibited causing osteoclasts to detach from the surface of mouse pariet al bone and attach to the endocranial membrane[J].Bone,2001,28(2):208-214.
[21]Miyamoto T.Regulators of osteoclast differentiation and cell-cell fusion[J].Keio J Med,2011,60(4):101-105.
[22]Siddiqi MH,Siddiqi MZ,Kang S,et al.Inhibition of Osteoclast Differentiation by Ginsenoside Rg3 in RAW 264.7 Cells via RANKL,JNK and p38 MAPK Pathways through a Modulation of Cathepsin K:An In Silico and In Vitro Study[J].Phytother Res,2015,29(9):1286-1294.
[23]Zhuo Y,Gauthier JY,Black WC,et al.Inhibition of bone resorption by the cathepsin k inhibitor odanacatib is fully reversible[J].Bone,2014,67:269-280.
[24]Reddy SV,Hundley JE,Windle JJ,et al.Characterization of the mouse tartrate-resistant acid phosphatase(TRAP)gene promoter[J].J Bone Miner Res,1995,10(4):601-606.
关注SCI论文创作发表,寻求SCI论文修改润色、SCI论文代发表等服务支撑,请锁定SCI论文网! 文章出自SCI论文网转载请注明出处:https://www.lunwensci.com/yixuelunwen/19148.html