SCI论文(www.lunwensci.com):
摘要:目的转录因子Nrf2在保护细胞对抗氧化损害时发挥重要作用,姜黄提取物(Curcumin,Cur)可上调细胞抗氧化酶的表达。本研究拟探讨Cur在肝脏细胞中能否通过诱导Nrf2核转位发挥抗氧化作用并进而减轻其胰岛素抵抗(Insulin resistance,IR)。方法人肝细胞系L02被分成4组,分别正常培养(Control组)、与葡萄糖氧化酶(Glucose oxidase)共培养(GO组)、与Cur及GO共培养(Cur+GO组)、与Wortmannin(Wor)和Cur及GO共培养(Cur+GO+Wor组)后,分别检测细胞氧化水平、细胞损害程度、Nrf2核转位状况及IR水平。结果GO共培养后显著增加了人肝细胞ROS、MDA、LDH及AST浓度,减低了GSH浓度,诱导肝细胞IR。L02使用Cur预处理后再与GO共培养能够减低GO引起的肝细胞损害所致指标升高,并能有效减低GO引起细胞内脂质过氧化及IR,这与Cur产生的促进Nrf2核转位效应一致。Wor能部分抑制Cur诱导的Nrf2核转位。结论Cur能够减低ROS导致的人肝细胞IR,可能是通过促进Nrf2核转位发挥作用。
关键词:姜黄提取物;肝细胞L02;氧化损害;胰岛素抵抗
本文引用格式:李强,张鼎,师喜云,等.激活转录因子Nrf2对肝细胞胰岛素抵抗的影响及信号通路[J].世界最新医学信息文摘,2019,19(80):55-57.
Effect of Activating Transcription Factor Nrf2 on Human Hepatocyte Insulin Resistance and Signaling Pathway
LI Qiang,ZHANG Ding,SHI Xi-yun,CHENG Yan-hui,WANG Bao-jian*
(Department of Internal Medicine,NO.988th Hospital of PLA,Zhengzhou Henan)
ABSTRACT:Objective Nrf2 is a transcription factor that plays a crucial role in the cellular protection against oxidative stress.Curcumin(Cur)has been reported to upregulate the expression of numerous reactive oxygen species(ROS)detoxifying genes in cells.This study was designed to investigate whether Cur could induced Nrf2 nuclear translocation and reduce ROS-mediated insulin resistance(IR)in cultured hepatocytes.Methods Human L02 hepatocytes were divided into four groups.Cells in Control group were incubated without special.Cells in GO group were incubated with glucose oxidase(GO).Cells in Cur+GO group were incubated with GO and Cur.Cells in Cur+GO+Wor group were incubated with GO,Cur and Wortmannin(Wor,PI3K inhibitor).Then oxidative stress,cellular damage,Nrf2 nuclear translocation and insulin resistance were measured.Results GO exposure significantly increased ROS,MDA,LDH and AST level,as well as causing IR.Cur pretreatment significantly attenuated these disturbances in intracellular ROS,liver enzyme activity and significantly antagonized the lipid peroxidation,GSH depletion and IR induced by GO in L02 hepatocytes.These effects paralleled Nrf2 nuclear translocation induced by Cur.Wor partially blocked Cur-induced Nrf2 nuclear translocation.Conclusion Thesefindings suggest that Cur could reduce ROS-mediated IR in hepatocytes,at least in part through nuclear translocation of Nrf2.
KEY WORDS:Curcumin;L02 hepatocytes;Oxidative stress;Insulin resistance
0引言
氧化应激可使肝脏内活性氧簇 ( reactive oxygen species, ROS) 增加进而导致肝细胞损害 [1]。如果不能及时清除这些分子, 可能诱导脂质过氧化并诱发急慢性组织损害、癌变及老化等 [2]。肝细胞可以通过还原型谷胱甘肽和异生物代谢酶等对细胞内氧化剂进行清理。核因子 E2 相关因子 2(Nrf2)可以调节多种抗氧化酶表达,其通常以无活性形式存在于细胞浆中,接受信号刺激时转移至胞核中发挥作用 [3],在肝脏中 Nrf2 对于防御氧化损伤有重要作用,Nrf2 基因敲除的小鼠肝脏 DNA 损害水平明显升高 [4]。IR 参与多种肝脏疾病发病过程。既往一项研究显示高浓度的过氧化氢及其代谢物导致 ROS 在细胞内蓄积,可导致脂肪细胞 3T3-L1 的 IR[5]。在高脂肪饮食的小鼠中,人们发现 IR 产生之前肝脏中 ROS 的基因表达上调,因此 ROS 可能是导致高脂肪食物诱发 IR 的重要原因 [6]。
Cur 是传统草药姜黄中的效应元素,具备抗氧化等多种作用。有研究发现 Cur 能够在人单核细胞中通过调控 Nrf2 增加 HO-1的表达水平 [7]。触发激酶信号通路是 Nrf2 激活的关键步骤,PI3K 等信号通路均参与 Nrf2 的激活 [8]。尽管 Cur 可以激活转录因子 Nrf2 有效调节细胞氧化还原平衡,但目前尚不清楚其通过何种形式影响 ROS 介导的 IR。在本研究中我们将探讨在人肝细胞内能否通过 Cur 减轻 GO 诱导的 IR。
1材料与方法
1.1材料
人肝细胞系 L02 购自武汉典型生物保藏中心;胎牛血清购自Gibco 公司;Cur 购自 Sigma 公司;Wor 购自 Cell Signaling 公司; Nrf2 抗体购自 Abzoom 公司;FITC 标记的羊抗兔的第二抗体购自 Abcam 公司;胰岛素购自 Sigma 公司;超氧化物探针(DHE)购自碧云天公司;丙二醛(MDA)和 GSH 检测试剂盒购自南京建成公司;细胞蛋白提取试剂盒购自 APPLYGEN 公司;光学显微镜、荧光显微镜购自奥林巴斯公司;流式细胞仪购自 bio-rad 公司;全自动生化分析仪购自贝克曼公司。
1.2方法
1.2.1细胞培养将人肝细胞系 L02 在细胞培养箱中与 RPMI1640及 15 % 胎牛血清共培养 48 h,每个培养皿中置入 5×106 个 L02 细胞。Control 组细胞未予特殊处理;GO 组培养皿加入含有 100 U/L GO 的培养液孵育 2 h 诱导细胞氧化损害模型;Cur+GO 组培养皿中肝细胞加入含 30 μMCur(Cur+GO+Wor 组再加入 0.1 μM Wor)孵育 12 h,后加入含有 100 U/L GO 的培养液孵育 2 h。细胞使用 PBS 洗涤 2 次,加入含有 100nM 胰岛素(Sigma 公司) 的培养液孵育 30min。
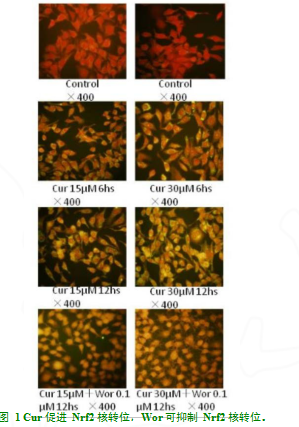
1.2.2免疫组化 L02 置于玻片上生长 48 h 后,分别将含 15 及 30 μM Cur 的培养液加入玻片上干预 6 h 及 12 h,部分 Cur 预处理后的细胞加入含 0.1 μM 的 Wor 的培养液干预 12 h,之后将标本用固定液作用 30 min,再加入 1:100 羊多克隆Nrf2 抗体作用 2 h, PBS 冲洗 5 次后再加入 1:50FITC 标记的羊抗兔的第二抗体孵育1 h,封片后在荧光显微镜下显像。
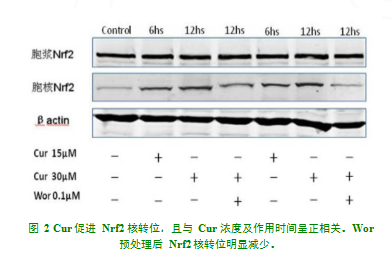
1.2.3Western Blot 实验收集细胞用于 Western Blot 实验, 按说明提取各组细胞蛋白质,将蛋白质加载到聚丙烯酰胺上进行凝胶及电泳后分别用不同的多克隆抗体(IR、p-IR、IRS-1、p-IRS-1、JNK、p-JNK)培养,后进行显色。
1.2.4流式细胞检测各组细胞收获并冲洗后与 4 μM 的超氧化物探针室温下避光孵育 30 min,分别在激发波长(488 nm)及发射波长(525 nm)下使用流式细胞仪测定。
1.2.5生化检测收集各组细胞,分别采用硫代巴比妥酸及微板试剂盒(南京建成公司)测量 MDA 及 GSH 水平。收集各组细胞培养液使用全自动生化分析仪(贝克曼公司)检测 AST、LDH 及Glu 浓度。
1.3统计学分析
各组数据以 ±s 显示,采用 ANOVA 分析及 q 检验,数据使用 SPSS 20 软件进行分析。P ≤ 0.05 具有统计学意义。
2结果
2.1各组细胞内 Nrf2 核转位的比较研究结果证实 Cur 预处理过的 L02 细胞系内 Nrf2 核转位水平明显高于 Control 组。在同等浓度条件下, 干预 12 h 较 6 h 可增加 Nrf2 核转位。L02 细胞胞浆内Nrf2 水平未见显著变化,Wor 干预后明显抑制了Nrf2 核转位(图 1)。
提取各组胞浆及胞核中的蛋白质进行 western blotting 实验,研究结果显示 Wor 部分抑制了 Cur 诱导的 Nrf2 核转位,然而,细胞胞浆内Nrf2 水平与是否接受Cur 及Wor 干预无明显关系(图 2)。
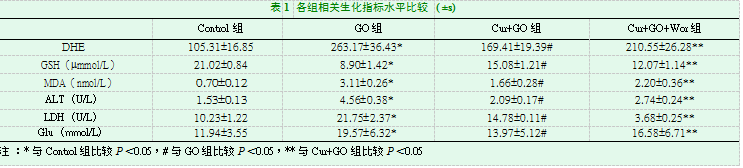
2.2各组细胞DHE、GSH、MDA、ALT、LDH及Glu的比较GO组的Glu浓度较Control组明显升高,Cur+GO组Glu浓度较GO组明显降低,Cur+GO+Wor组Glu浓度则介于GO组和Cur+GO组之间。GO组较Control组DHE、MDA、LDH及AST浓度显著升高,GSH浓度显著降低;Cur+GO组DHE、MDA、LDH及AST浓度水平较GO组显著减低;Cur+GO+Wor组上述指标水平介于GO组及Cur+GO组之间(表1)。
2.3各组细胞胰岛素抵抗指标的比较加入胰岛素干预后,细胞内IR磷酸化启动。收集各组细胞后使用western blotting检测IR及IRS-1水平。GO组较Control组未见明显IR磷酸化升高,且IR磷酸化水平与Cur及Wor干预无明显关系;与Control组比较,GO组IRS-1磷酸化水平显著降低,Cur+GO组IRS-1明显升高,Cur+GO+Wor组IRS-1磷酸化水平则介于GO组和Cur+GO组之间;与Control组比较,GO组JNK磷酸化水平显著升高,Cur+GO组JNK较GO组减低,Wor干预则部分抑制了Cur减低JNK磷酸化的效应(图3)。
3讨论
肝脏细胞常受氧化损害影响,可导致肝功能异常、肝细胞死亡并影响肝细胞受损后修复过程。因此,肝脏细胞中严密的氧化还原调节非常重要[9,10]。在本实验中我们发现姜黄提取物干预能促使Nrf2向细胞核转移并减轻L02细胞系氧化所致损害。同时我们研究发现Wor能降低姜黄提取物的这种作用,证明PI3K途径参与了姜黄提取物诱导的Nrf2核转位。氧化损害及抗氧化剂激活PI3K信号通路后可以调节肌动蛋白微丝的重排,且肌动蛋白的重排破坏了Nrf2-Keap1复合物,进而促进Nrf2核转位[11,12]。Wor不但抑制了Nrf2核转位,而且阻碍姜黄提取物发挥抗氧化及抗IR作用。因此在人肝细胞系L02中PI3K可能参与了Nrf2核转位。既往研究发现氧化代谢产物能够抑制下游PI3K-Akt信号通路[13]。另一项有关高脂饮食诱导肥胖小鼠的研究证实在肝脏及脂肪组织出现IR之前曾发生过ROS及氧化损害上调情况,并且ROS生成可能是高脂肪饮食诱发IR的关键环节[14]。在本研究中,我们发现在人肝细胞系L02中ROS同样可以诱发IR,而姜黄提取物干预可以降低ROS水平进而改善IR。
IRS-1和IRS-2激酶磷酸化可以抑制ROS介导的IR[15,16]。前期研究已经证实ROS通过JNK途径促进IRS-1上Ser307位点磷酸化,进而通过IGF1受体抑制IRS-1上的Tyr608[17]。在本研究中我们证实ROS激活JNK后抑制了IRS-1的磷酸化水平,而姜黄提取物预处理过的肝细胞内ROS水平减低,减少了JNK参与,从而增加IRS-1磷酸化进而改善IR。
HO-1在体内及体外实验中均能改善IR[18],Cur能促进Nrf2核内转移有效上调HO-1水平[19]。在本研究中我们证实了Cur同样能够改善人肝细胞L02中的IR,分析与Cur能降低L02内ROS水平及升高HO-1水平有关。我们的研究结果提示Nrf2在减轻L02细胞系IR过程中发挥了关键作用。因此Nrf2可能成为治疗IR的新靶点。通过Cur等药物作用激活Nrf2进而减轻患者肝脏疾病所致IR可能成为一种新的治疗策略。
Cur能改善IR作用已经在动物模型中得到了证实[20],有研究者发现对高脂饮食大鼠提供姜黄提取物后其IR明显减轻[21]。然而目前尚缺乏姜黄提取物对人类IR有无影响的报导。我们的研究结果提示姜黄提取物可以促进Nrf2向核内转移进而调节氧化损害及IR,并且证明在人L02细胞系中姜黄提取物可以通过调节Nrf2向胞核转移改善ROS诱发的IR。鉴于很多水果和蔬菜中姜黄提取物含量较高,食用富含姜黄提取物的食物可能成为改善肝脏疾病的氧化损害及IR有效手段。此外,本实验结果说明有效激活Nrf2可能成为预防及治疗代谢综合症患者的IR的探索方向。
参考文献
[1]Liu D,Xue J,Liu Y,et al.Inhibition of NRF2 signaling and increased reactiv e oxygen species during embryogenesis in a rat model of retinoic acid-induced neural tube defects[J].Neurotoxicology,2018,69 84-92.
[2]Srivastava S,Saksena AK,Khattri S,et al.Curcuma longa extract reduces inflammatory and oxidative stress biomarkers in osteoarthritis of knee:a four-month,double-blind,randomized,placebo-controlled trial[J].Inflammopharmacology,2016,24(6):377-388.
[3]Yan H,Huang Z,Bai Q,et al.Natural product andrographolide alleviated APAP-induced liver fibrosis by activating Nrf2 antioxidant pathway[J].Toxicology,2018,396-397 1-12.
[4]Mahmoud AM,Hozayen WG,Ramadan SM.Berberine ameliorates methotrexate-induced liver injury by activating Nrf2/HO-1 pathway and PPARγ,and suppressing oxidative stress and apoptosis in rats[J].Biomed Pharmacother,2017,94 280-291.
[5]Zhou MS,Liu C,Tian R,et al.Skeletal muscle insulin resistance in salt-sensitive hypertension:role of angiotensin II activation of NF-κB[J].Cardiovasc Diabetol,2015,1;14:45.
[6]Han CY.Roles of Reactive Oxygen Species on Insulin Resistance in Adipose Tissue[J].Diabetes Metab J,2016,40(4):272-9.
[7]Kim JK,Jang HD.Nrf2-mediated HO-1 induction coupled with the ERK signaling pathway contributes to indirect antioxidant capacity of caffeic acid phenethyl ester in HepG2 cells[J].Int J Mol Sci,2014,15(7):12149-65.
[8]Ye S,Chen M,Jiang Y,et al.Polyhydroxylated fullerene attenuates oxidative stress-induced apoptosis via a fortifying Nrf2-regulated cellular antioxidant defence system[J].Int J Nanomedicine,2014,9:2073-87.
[9]Das M,Basu S,Banerjee B,et al.Hepatoprotective effects of green Capsicum annum against ethanol induced oxidative stress,inflammation and apoptosis in rats[J].J Ethnopharmacol,2018,227 69-81.
[10]Zampino R,Marrone A,Rinaldi L,et al.Endotoxinemia contributes to steatosis,insulin resistance and atherosclerosis in chronic hepatitis C:the role of pro-inflammatory cytokines and oxidative stress[J].Infection,2018,46(6):793-799.
[11]Lee SB,Sellers BN,DeNicola GM.The Regulation of NRF2 by Nutrient-Responsive Signaling and Its Role in Anabolic Cancer Metabolism[J].Antioxid Redox Signal,2018,29(17):1774-1791.
[12]Zhang JC,Yao W,Dong C,et al.Keap1-Nrf2 signaling pathway confers resilience versus susceptibility to inescapable electric stress[J].Eur Arch Psychiatry Clin Neurosci,2018,268(8):865-870.
[13]Zou Y,Hu M,Lee J,et al.Nrf2 is essential for timely M phase entry of replicating hepatocytes during liver regeneration[J].Am J Physiol Gastrointest Liver Physiol,2015,308(4):G262-8.
[14]Villagarcía HG,Sabugo V,Castro MC,et al.Chronic Glucocorticoid-Rich Milieu and Liver Dysfunction[J].Int J Endocrinol,2016:7838290.
[15]Nandipati KC,Subramanian S,Agrawal DK.Protein kinases:mechanisms and downstream targets in inflammation-mediated obesity and insulin resistance[J].Mol Cell Biochem,2017,426(1-2):27-45.
[16]Steinbrenner H.Interference of selenium and selenoproteins with the insulin-regulated carbohydrate and lipid metabolism[J].Free Radic Biol Med,2013,65 1538-1547.
[17]Solinas G,Becattini B.JNK at the crossroad of obesity,insulin resistance,and cell stress response[J].Mol Metab,2016,6(2):174-184.
[18]Lee W,Yun S,Choi GH,et al.Fibronectin Type III Domain Containing 4 attenuates hyperlipidemia-induced insulin resistance via suppression of inflammation and ER stress through HO-1 expression in adipocytes.Biochem Biophys Res Commun,2018,502(1):129-136.
[19]Kuryszko J,Sławuta P,Sapikowski G.Secretory function of adipose tissue[J].Pol J Vet Sci,2016,19(2):441-6.
[20]Maithili Karpaga Selvi N,Sridhar MG,Swaminathan RP,et al.Curcumin Attenuates Oxidative Stress and Activation of Redox-Sensitive Kinases in High Fructose-and High-Fat-Fed Male Wistar Rats[J].Sci Pharm,2014,83(1):159-75.
[21]Eshaghian A,Khodarahmi A,Safari F,et al.Curcumin attenuates hepatic fibrosis and insulin resistance induced by bile duct ligation in rats[J].Br J Nutr,2018,120(4):393-403.
关注SCI论文创作发表,寻求SCI论文修改润色、SCI论文代发表等服务支撑,请锁定SCI论文网! 文章出自SCI论文网转载请注明出处:https://www.lunwensci.com/yixuelunwen/14499.html