摘要:阿卡波糖是一种α-糖苷酶抑制剂,被用于治疗Ⅱ型糖尿病。它可抑制消化系统中的α-糖苷水解酶活性,降低血糖。工业上主要利用游动放线菌及其突变菌株生产阿卡波糖。鉴于当代社会患糖尿病人数的急剧增加,提高阿卡波糖的产量,成为目前亟待解决的问题。文章主要对阿卡波糖的生物合成途径、菌株改造、发酵工艺优化等研究进展展开综述。
关键词:阿卡波糖,生物合成,发酵优化,菌株改造
目前,患糖尿病的人数逐渐增多,引起了社会的广泛关注。糖尿病会引起多种并发症,如心血管疾病、高血压、肾病等,给世界公共卫生和卫生保健系统带来了巨大的挑战[1-2]。截至2021年,全球糖尿病患者已达到约5.29亿。其中,大部分糖尿病类型为Ⅱ型糖尿病。现有学者对不同国家地区各年龄层次的人口进行了调查研究,并得出了如下结论:预计到2050年,全球患糖尿病的人数将达到13.1亿人,约是2021年的2.5倍[3]。糖尿病患病率的上升,使人们对抗糖尿病药物的需求量不断增长。阿卡波糖是由假二糖阿卡维糖(acarviose)通过α-1,4-糖苷键与麦芽糖残基连接形成的假四糖,是一种针对Ⅱ型糖尿病的干预和治疗药物,能有效抑制消化系统中α-淀粉酶、麦芽糖酶等α-糖苷水解酶活性,降低消化过程中碳水化合物的水解速率,进而达到控制血糖的目的。阿卡波糖具有低毒性副作用等特点,被广泛用于Ⅱ型糖尿病的治疗中[4]。
阿卡波糖的工业化生产主要依赖放线菌Actinoplanes utahensis ZJB-08196、放线菌Actinoplanes sp.SE50/110及其突变株[5-6],且采用的发酵方式多为分批补料发酵。随着研究不断深入,阿卡波糖生物合成机制逐渐被揭示,同时对生产菌株的高效调控方法也在不断更新,推动了阿卡波糖产量的持续提升。
本文结合相关报道,概述了阿卡波糖生物合成的机理,并分析了微生物发酵生产阿卡波糖的研究进展,以期为阿卡波糖生产菌株的改良、代谢调控、发酵优化等提供参考。
1阿卡波糖及其主要副产物的合成机制
1.1阿卡波糖的生物合成机制
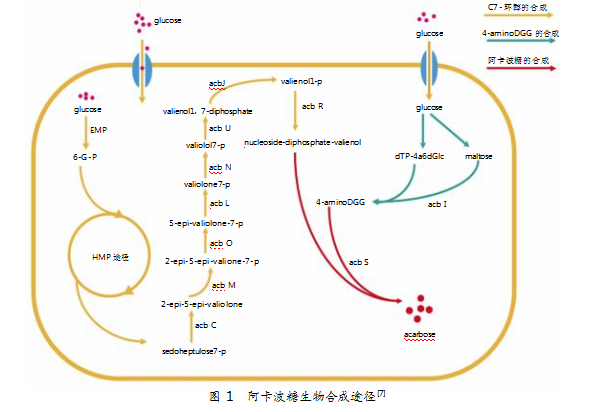
阿卡波糖由C7-环醇与麦芽糖组成。其中,C7-环醇主要通过C-N键连接到脱氧基糖上形成阿卡波糖[7]。在过去的几十年间,科学家通过同位素示踪[8-10]、基因敲除[11]、生物化学实验[12-13],以及基因组学、转录组学、蛋白质组学等研究[14-16],完成了对Actinoplanes sp.SE50/110菌株中阿卡波糖生物合成相关基因的功能分配。研究显示,阿卡波糖的合成、转运、代谢相关酶均由acb基因簇编码。
Actinoplanes sp.SE50/110菌株是目前阿卡波糖生产中应用最为广泛的菌株,也是被全面深入研究的菌株。在SE50/110菌株中,阿卡波糖的合成大致分为3部分,分别为C7-环醇的合成、4-氨基-4,6-双脱氧葡萄糖(4-aminoDGG)的合成以及阿卡波糖的合成[7]。
C7-环醇的合成途径如图1所示(黄色路径)[7]。7-磷酸景天庚酮糖(sedoheptulose7-phosphate)经C7-环醇合成酶催化,形成环化产物2-表-5-表-有效醇酮(2-epi-5-epi-valiolone)[14],再由ATP依赖性磷酸激酶催化,形成2-表-5-表-有效醇酮-7-磷酸(2-epi-5-epi-valiolone-7-p),进而通过差向异构酶作用,形成5-表-有效醇酮-7-磷酸(5-epi-valiolone-7-p),通过acb族基因编码相关酶的作用,最终生成核苷二磷酸-链霉菌(nucleoside diphosphate-valienol)。4-氨基-4,6-双脱氧葡萄糖由麦芽糖与dTP-4a6dGlc在acbI编码的糖基转移酶的作用下形成;阿卡波糖由nucleoside diphosphate-valienol与4-aminoDGG在acbS编码的糖基转移酶的催化下形成。
acb族负责编码一系列与阿卡波糖合成、转运等相关的酶。其编码合成相关的酶具体如表1所示。
1.2其他主要副产物的合成机制
阿卡波糖作为一种次级代谢产物,其合成过程会产生一些其他代谢产物,而这些副产物会造成一部分阿卡波糖合成前体流失,导致后续分离纯化的难度加大。因此,解析并控制阿卡波糖生产过程中副产物的合成,是提高产量的一个重要途径。目前,已知的阿卡波糖生产过程产生的副产物包括组分A、组分C、组分B、组分4a、4b、4c以及组分D[4,17-19]。在这些副产物中,只有组分A、组分C的合成机制得到阐明,其余副产物的合成机制尚未完全明晰。
1.2.1组分A的形成机制
组分A由阿卡维糖以1,4-糖苷键与麦芽酮糖(1-α-葡萄糖-4-果糖)相连后形成,是阿卡波糖在一定条件下异构形成的[19]。组分A的生成不仅会导致发酵后期阿卡波糖的产量下降,还会加大作为药品使用的阿卡波糖分离纯化的难度。因此,在发酵过程中对组分A进行严格控制,有利于提高阿卡波糖的产量并降低纯化成本。
1.2.2组分C的形成机制
组分C由阿卡维糖以1,4-糖苷键与海藻糖(1-α-葡萄糖-1-葡萄糖)相连形成,是一种发酵后期的产物,其产量与阿卡波糖合成量密切相关[4]。这一组分是在发酵后期细胞裂解后,阿卡波糖与发酵液中的糖苷转移酶或海藻糖合成酶作用所产生的。Actinoplanes sp.SE50/110在合成阿卡波糖的过程中,会产生麦芽寡糖基海藻糖合成酶(TreY途径),而TreY能催化阿卡波糖转化为组分C[18]。组分C的产生,不仅会导致阿卡波糖的产量下降,也会加大后续分离纯化的难度。因此,控制发酵过程中组分C的含量具有重要的现实意义。
2诱变育种
在工业化生产中,通过常规的诱变育种来改造阿卡波糖生产菌株,可以提高阿卡波糖产量并减少副产物生成。张琴等[20]运用紫外线、亚硝基胍(NTG)、硫酸二乙酯(DES)、亚硝酸处理等方法,对Actinoplanes sp.LA-H6进行诱变,并筛选得到了一株高产突变株。其研究发现,该菌株发酵单位为2 856μg/mL,比出发菌株LA-H6高出35%。黄建平、郑燕[21]在对Actinoplanes sp.LA-H6实施紫外及NTG等诱变处理后,经多轮筛选和摇瓶发酵实验,最终获得了一株高产突变株SIPI-AK。其研究发现,该突变株的阿卡波糖发酵产量超过了2 850μg/mL,与出发菌株相比提高了约36%,且其组分A、组分C的含量明显减少。牛鑫淼[22]利用紫外诱变和微波诱变,对A.utahensis ZJB-08196进行处理,并获得了2个突变株UN-52和WN-44。其研究发现,阿卡波糖产量分别达到了5 210.1 mg/L和5 110 mg/L,相较出发菌株分别提高了13.7%和2.8%;以UN-52和WN-44为亲本通过基因组重排得到的突变株F61,发酵液产量达到了5 672.8 mg/L。周建[23]通过对Actinoplanes sp.A01进行多轮迭代常温室压等离子体(ARTP)诱变育种,获得了一株阿卡波糖高产菌株Actinoplanes sp.AH-02,并通过摇瓶发酵实验测得,产量达到了3 901.50μg/mL,比出发菌株的产量提高了64.97%。
3基因工程
Actinoplanes sp.SE50/110的阿卡波糖生物合成基因簇已被鉴定并测序。该簇中大多数已鉴定的基因,已完成了相关功能蛋白的分配,同时对Actinoplanes sp.SE50/110中的阿卡波糖生物合成途径也有了较为完整的了解。近基因组学、转录组学、蛋白质组学等方面的研究,为基因编辑提供了潜在的靶点,使高效的编辑方法成为目前研究的热点。例如,WOLF等[24]将CRISPR/Cas9技术用于Actinoplanes sp.SE50/110,成功证明了在阿卡波糖生产菌株运用基因组编辑的功能,为通过基因编辑调节阿卡波糖的生产提供了新的工具和方法。
3.1调节基因表达水平
利用基因工程对阿卡波糖生物合成过程中的关键基因实施调控,以调节其表达水平、增强阿卡波糖的生物合成途径,是基因工程运用的主要方法之一。李振鑫[25]通过转录组分析发现,TetR家族的转录调节因子TetR1能促进acbB和acbD基因的表达,对阿卡波糖的合成具有积极作用。同时,其构建了Actinoplanes sp.SIPI12-34过表达TetR1菌株,在摇瓶培养96 h后发现,SIPI12-34/TetR1的产量达到了2.18 g/L,比亲本SIPI12-34提高了约25%。解慧欣等[26]通过考察不同麦芽糖浓度对阿卡波糖产量的影响,发现转运蛋白acbW的表达量与麦芽糖浓度呈正相关,进一步将其敲除后发现,菌株的生长减弱且没有生成阿卡波糖,在将其分别过表达acbW和acbW XY基因后,Actinoplanes sp.SE50/110的阿卡波糖产量提高了6.4%和8%。解慧欣[27]通过比较高低产菌株基因组间的差异,发现并验证了2个主效基因:A CWT_4325和A CWT_7629,在将这2个基因分别在Actinoplanes sp.SE50/110基因组序列中进行同源性比对后发现,4个同源性较高的基因分别为ACPL_2718、ACPL_3172、ACPL_5664和ACPL_6548。随后,其在Actinoplanes sp.SE50/110中对这些基因进行了敲除,在摇瓶发酵后发现,在缺失ACPL_3172基因后,阿卡波糖的产量提高了11.3%。
3.2加强合成前体的供应
3.2.1强化合成路径
阿卡波糖作为一种次级代谢产物,利用基因工程强化合成途径来提高产量是一种常用的方法。张欣等[28]通过敲除阿卡维基转移酶基因acbD、淀粉酶基因acbE和acbZ,初步解析了阿卡波糖胞外代谢相关基因与阿卡波糖合成、类似物积累之间的关系,为后续研究阿卡波糖的胞外代谢途径以及高效调控其代谢过程奠定了基础。周健[23]基于CRISPR/Cas9技术,对诱变所获得的高产菌株的melC2(编码酪氨酸酶基因)进行敲除,同时过表达acbS(编码假糖基转移酶),构建了基因工程菌株Actinoplanes sp.AH-ΔmelC2-acbS。在对其摇瓶发酵实验后发现,阿卡波糖产量达到了4 867.21μg/mL,比原始菌株产量提高了104.07%。LI等[29]将Actinoplanes sp.SE50/110中阿卡波糖合成基因簇的部分低表达基因进行了过表达,并发现过表达acbY XW、acbU、acbA和acbB的工程菌株的产量分别提高了约14%、45%、30%和16%。王雅丽[30]构建了阿卡波糖生产菌株Actinoplanes sp.SE50/110基因组规模代谢网络模型,并基于该模型详细阐述了阿卡波糖的代谢途径及特点,分析了阿卡波糖生产过程中的代谢节点,包括磷酸戊糖途径、糖酵解途径和氨基转移酶催化的谷氨酸合成途径,同时根据这些结果,采用FSEOF方法预测出了基因ACPL1861、ACPL6461、ACPL1328和ACPL6750为潜在的过表达基因靶点,为后续代谢工程改造提供了一定参考。
3.2.2下调代谢支路
阿卡波糖的生产过程会积累许多杂质组分,而这些代谢支路会导致阿卡波糖合成前体流失[11]。ZHAO等[31]通过敲除组分C合成过程中的关键基因treY,消除了组分C,并在后续摇瓶发酵实验中发现,阿卡波糖的产量从2.7 g/L提高到了2.99 g/L,且在发酵液中没有检测到组分C。余贞等[32]利用同源重组敲除了菌株Actinoplanes sp.8-22中的treY基因,得到了突变株Y810。其发酵结果显示,组分C的含量与原始菌株相比减少了90%。LI等[29]通过对分支途径中的关键基因ACPL 8310(编码水解酶)进行敲除,减少了中间产物的流失,使阿卡波糖产量由原来的1.74 g/L提升至2.02 g/L。同时,其敲除了糖原合成酶基因并对糖原磷酸化酶基因进行了过表达,减少了1-磷酸葡萄糖的消耗,增加了阿卡波糖合成前体的积累,最终使阿卡波糖的产量提升至2.28 g/L。SOPHIA等[33]通过对4-α-葡聚糖转移酶acbQ的研究,指出在Actinoplanes sp.SE50/110合成阿卡波糖的过程中,7-磷酸阿卡波糖是acbQ更相关的受体。在4-α-葡聚糖转移反应后,鉴定出含有多达4个额外葡萄糖分子的较长阿卡维酰代物(α-阿卡维酰-1,4-麦芽糖)。这些是阿卡波糖生产过程中产生的不良副产物,可使acbQ成为基因组和分子生物学水平上进一步的研究靶点。
4发酵工艺优化
4.1发酵培养基优化
4.1.1碳源、氮源的优化
在生物合成阿卡波糖的过程中,微生物对不同发酵底物利用程度的不同,导致其产量存在较大的差别[34]。首先,不同碳源可能会影响阿波卡糖杂质组分的生成。由阿卡波糖的合成途径可知,麦芽糖作为阿卡波糖合成过程中的重要前体物质,其添加量会对产量产生较大影响。高敬红等[35]通过对Actinoplanes sp.AC17#进行单一碳源的发酵实验,发现在阿卡波糖的合成过程中使用麦芽糖作为单一碳源得到的产量最高,超过了1 100 mg/L。随后,其开展了混合碳源发酵实验,发现葡萄糖与麦芽糖的混合物是最佳碳源,当麦芽糖的含量达到总碳源的60%时,阿卡波糖的发酵水平最高,超过了1 800 mg/L。LI等[35]通过研究不同碳源比例对Actinoplanes sp.A56生产阿卡波糖的影响,发现在仅使用麦芽糖或葡萄糖作为碳源的情况下,阿卡波糖的产量分别为1 535.63 mg/L和1 137.14 mg/L。当麦芽糖和葡萄糖的比例为3∶1时,阿卡波糖的产量最高,达到了2 111.62 mg/L,随后在100 L摇瓶培养实验中进一步探究了碳源浓度与阿卡波糖产量间的关系,并发现当总糖质量浓度为7.5~8.0 g/mL时,阿卡波糖的产量达到了3 746.56 mg/L。在此基础上,其开展了放大实验,将总糖和还原糖作为放大参数,基于100 L发酵罐的结果,发现在30 m3发酵罐中总糖和还原糖分别保持在7.5~8.0和4.5~5.0 g/100mL,发酵时间为168 h时,阿卡波糖的产量达到了4 327 mg/L。LEE等[36]利用同位素示踪法,对比分析了阿卡波糖生产菌株Actinoplanes sp.对不同种类氮源的利用程度,发现在发酵过程中谷氨酸是最有效的氮源,其次是NH4Cl。陈喆明[37]通过单因素实验、正交实验对培养基进行优化,确定了最佳培养基组成为:葡萄糖30 g/L、麦芽糖糖化液312.5 mL(50 g麦芽糖)、黄豆饼粉15 g/L、谷氨酸钠6 g/L、碳酸钙2 g/L、氯化钙3 g/L、氯化铁1.2 g/L、磷酸氢二钾0.8 g/L。在此培养基下,阿卡波糖的产量为5 250.40 mg/L。郑鲁霞[38]通过优化Actinoplanes utahensis的发酵培养基,得出最优配方为:葡萄糖10 g/L、麦芽糖40 g/L、酵母提取物2.5 g/L、蛋白胨2.5 g/L、谷氨酸钠5 g/L、甘油3 g/L、MgSO4·7H2O 1 g/L、K2HPO4 1 g/L、FeSO4·7H2O 0.1 g/L。在此条件下发酵7 d,阿卡波糖产量达到了0.64 mg/mL,比原始发酵培养基提高了33%。
4.1.2添加其他物质
在发酵过程中添加其他物质,也会影响微生物的生长代谢,导致产量发生变化,同时也可能影响其他副产物的形成。CHOI等[39]发现,井冈霉烯胺(Valienamine)能提高阿卡波糖的产量并显著降低组分C的含量。在发酵实验中加入10μmol/L井冈霉烯胺,Actinoplanes sp.CKD485-16中组分C的含量下降了90%,同时阿卡波糖的产量也得到了显著提高。XUE等[40]发现,加入20 mg/L井冈霉烯胺后,A.utahensis ZJB-08196的阿卡波糖产量从3 560 mg/L增加到了4 950 mg/L。王雅丽[30]发现,在Actinoplanes sp.SE50/110发酵过程中添加5 mg/L的烟酸后,阿卡波糖的产量达到了0.697 g/L,相比对照组产量提高了53.5%。SUN等[41]发现,在发酵培养基中添加20~100μmol/L的S-腺苷甲硫氨酸后,菌株Actinoplanes utahensis ZJB08196的阿卡波糖产量提高了10%~30%。陈喆明[37]发现,向发酵培养基中添加金属离子对阿卡波糖的合成具有促进作用。其中,Fe3+对阿卡波糖合成的促进作用尤为显著;通过单因素实验发现,Fe3+的质量浓度在1.2 g/L时,阿卡波糖的产量最大。
4.2发酵工艺参数优化
4.2.1优化发酵时的温度
优化微生物发酵生产时的温度,可显著提高微生物的生长发育水平。李振鑫[25]通过发酵温度的单因素实验,发现当培养温度为28℃和30℃时,生长状况较好,且在30℃下菌株的阿卡波糖产量高于28℃下的产量,最终总结30℃为Actinoplanes sp.SIPI2207菌株的最佳发酵温度。组分A是阿卡波糖在一定温度下形成的。周鲁谨等[42]在放罐后的温度预处理阶段,通过将料液的温度控制在0~25℃,显著减少了组分A的产生。因此,通过优化发酵时的温度,可有效控制组分A的产生,减少阿卡波糖向组分A的转化。
4.2.2优化发酵时的pH
pH是与微生物生长密切相关的因素,能调控微生物的代谢水平,从而影响产量。LI等[43]对Actinoplanes sp.A56在30 000 L发酵罐中的环境参数进行优化,并通过单因素实验发现,当pH在7~7.2范围时,阿卡波糖的产量达到4 507 mg/L,显著高于pH为6.8~7.0和7.2~7.4时的产量。任飞[44]通过探究不同pH对阿卡波糖合成的影响,发现在发酵前期pH为7时,有利于菌体的生长但不利于阿卡波糖的合成;在发酵后期pH为8时,有利于阿卡波糖的合成。最终通过两阶段不同的pH培养模式并结合多种优化策略,使阿卡波糖的产量达到了6 210 mg/L,与对照组相比提高了85.7%。
4.2.3优化发酵时的渗透压
姜玮等[45]发现,在阿卡波糖发酵前期渗透压维持在300 mOsm/kg、发酵中后期维持在400~500 mOsm/kg,以及麦芽糖浓度维持在6%时,菌株的发酵水平显著提高,在50L发酵罐中的产量达到了3 360 mg/L,相较于对照组提高了50%。CHENG等[46]以Actinoplanes sp.A56为研究对象,探究了不同发酵时间和渗透压对阿卡波糖产量的影响。结果表明,在发酵时间为49~120 h、渗透压为450~500 mOsm/kg,以及发酵时间为121~168 h、渗透压为250~300 mOsm/kg时,与49~168 h发酵时间、450~500 mOsm/kg渗透压相比,组分C的含量从498.2 mg/L下降到了307.2 mg/L,而阿卡波糖产量从3 431.9 mg/L增加到了4 132.8 mg/L。
4.2.4其他工艺参数的优化
王子宝[47]通过对发酵罐中的通气量、进气方式、搅拌形式等因素进行考察优化,最终将Actinoplanessp.阿卡波糖的产量提升了15%,并使发酵过程中的能耗降低了20%。黄建平、郑燕[48]研究了不同发酵阶段溶解氧水平对放线菌发酵水平的影响,并提出了提高发酵后期摇床转速、降低补料浓度的溶氧控制等策略,使阿卡波糖的产量较对照组提升了11.98%。LI等[43]通过控制Actinoplanes sp.A56发酵过程的搅拌速度,使发酵罐中的溶解氧(DO)浓度分别为20%、30%、40%和50%,并发现虽然细胞生长差异很小,但最终的阿卡波糖产量存在显著差异。当DO浓度控制在40%、50%时,发酵168 h后阿卡波糖产量最高,分别为4 956 mg/L和4 880 mg/L,相较20%、30%时阿卡波糖的产量(4 223 mg/L和4 418 mg/L)得到了显著提高。
4.3分批补料发酵
分批补料发酵作为提高发酵水平的有效方法,同样也适用于阿卡波糖的生产。蔡成平[49]在Actinoplanes utahensis GNSR-9发酵24、48、96、120 h时定期补加2 mL发酵培养基(由葡萄糖、麦芽糖糖化液、无机盐等成分构成),使阿卡波糖的产量达到了最高,为6 632.03 mg/L,为工业化发酵生产提供了一定的实践基础。魏淑梅等[50]通过补加不同量的麦芽糖,发现在48 h单次补入3%的麦芽糖效果最佳,产量达到了3 462 mg/L,与对照组相比提高了21%。在36、48、60 h分别补入1.2%的麦芽糖后,阿卡波糖的产量达到了3 644 mg/L,相较对照组提高了27.4%。LI等[30]在发酵48、72、96和120 h时分别添加20 g/L葡萄糖,并发现Actinoplanes sp.SIPI2207菌株在168 h时阿卡波糖发酵产量达到了8.04 g/L。俞晓芸等[51]通过摇瓶发酵实验,在原补料工艺(3.0%葡萄糖)的基础上,探究了补入不同质量浓度麦芽糖、不同种类氮源对阿卡波糖发酵水平的影响,发现在72、96、120 h时分别补加麦芽糖1.5%、3.0%、5.0%,能有效促进阿卡波糖的合成,且阿卡波糖的发酵水平均超过了7 000μg/mL,与对照组相比提高了21.0%~27.0%。当补料配方为葡萄糖3.0%、麦芽糖1.5%,并以0.4%黄豆粉和0.05%味精作为复合氮源时,发酵水平最高,达到了8 227μg/mL。
5总结与展望
鉴于目前全球糖尿病的发展趋势,提高阿卡波糖的产量成为医学领域重要的研究课题。本文概述了阿卡波糖的生物合成路径,并提出了提高阿卡波糖产量的方法,包括诱变育种、基因工程、优化发酵工艺等,对揭示阿卡波糖的合成途径、提高阿卡波糖产量作出了一定贡献。然而,阿卡波糖作为一种次级代谢产物,在合成过程中仍有许多副产物的合成机制尚不明确。同时,阿卡波糖合成过程更是涉及多种基因,不仅有合成基因,还有调控、修饰、转运等相关基因。想要高效调控阿卡波糖合成,还须进行更深入的探讨。近年来,随着基因工程、代谢工程等技术的飞速发展,阿卡波糖的调控、修饰、转运等相关机制也在不断被揭示,有望高效调控阿卡波糖的生产过程。
参考文献
[1]DESHPANDE A D,HARRIS-HAYES M,SCHOOTMAN M.Epidemiology of diabetes and diabetes-related complications[J].Physical Therapy,2008,88(11):1254-1264.
[2]MA R C W.Epidemiology of diabetes and diabetic complications in China[J].Diabetologia,2018,61(6):1249-1260.
[3]ONG K L,STAFFORD L K,MCLAUGHLIN S A,et al.Global,regional,and national burden of diabetes from 1990 to 2021,with projections of prevalence to 2050:A systematic analysis for the Global Burden of Disease Study 2021[J].The Lancet,2023,402(10397):203-234.
[4]WEHMEIER U F,PIEPERSBERG W.Biotechnology and molecular biology of theα-glucosidase inhibitor acarbose[J].Applied Microbiology and Biotechnology,2004,63(6):613-625.
[5]ORTSEIFEN V,KALINOWSKI J,P譈HLER A,et al.The complete genome sequence of the actinobacterium Streptomyces glaucescens GLA.O(DSM 40922)carrying gene clusters for the biosynthesis of tetracenomycin C,5'-hydroxy streptomycin,and acarbose[J].Journal of Biotechnology,2017,262:84-88.
[6]ROCKSER Y,WEHMEIER U F.The gac-gene cluster for the production of acarbose from Streptomyces glaucescens GLA.O-Identification,isolation an characterization[J].Journal of Biotechnology,2009,140(1-2):114-123.
[7]TSUNODA T,SAMADI A,BURADE S,et al.Complete biosynthetic pathway to the antidiabetic drug acarbose[J].Nature Communications,2022,13(1):3455.
[8]MAHMUD T,TORNUS I,EGELKROUT E,et al.Biosynthetic studies on theα-glucosidase inhibitor acarbose in Actinoplanes sp.:2-epi-5-epi-valiolone is the direct precursor of the valienamine moiety[J].Journal of the American Chemical Society,1999,121(30):6973-6983.
[9]ARAKAWA K,BOWERS S G,MICHELS B,et al.Biosynthetic studies on theα-glucosidase inhibitor acarbose:The chemical synthesis of isotopically labeled 2-epi-5-epi-valiolone analogs[J].Carbohydrate Research,2003,338(20):2075-2082.
[10]DEGWERT U,VAN HULST R,PAPE H.Studies on the biosythesis of theα-glucosidase inhibitor acarbose:Valienamine,a m-C7N unit not derived from the shikimate pathway[J].The Journal of Antibiotics,1987,40(6):855-861.
[11]ZHAO Q,LUO Y,ZHANG X,et al.A severe leakage of intermediates to shunt products in acarbose biosynthesis[J].Nature Communications,2020,11(1):1468.
[12]ZHANG C S,STRATMANN A,BLOCK O,et al.Biosynthesis of the C7-cyclitol moiety of acarbose in Actinoplanes species SE50/110[J].Journal of Biological Chemistry,2002,277(25):22853-22862.
[13]STRATMANN A,MAHMUD T,LEE S,et al.The AcbCprotein from Actinoplanes species is a C7-cyclitol synthase related to 3-Dehydroquinate synthases and is involved in the biosynthesis of theα-Glucosidase inhibitor acarbose[J].Journal of Biological Chemistry,1999,274(16):10889-10896.
[14]XIE H X,ZHAO Q Q,ZHANG X,et al.Comparative functional genomics of the acarbose producers reveals potential targets for metabolic engineering[J].Synthetic and Systems Biotechnology,2019,4(1):49-56.
[15]WENDLER S,OTTO A,ORTSEIFEN V,et al.Comparative proteome analysis of Actinoplanes sp.SE50/110 grown with maltose or glucose shows minor differences for acarbose biosynthesis proteins but major differences for saccharide transporters[J].Journal of Proteomics,2016,131:140-148.
[16]SCHWIENTEK P,WENDLER S,NESHAT A,et al.Comparative RNA-sequencing of the acarbose producer Actinoplanes sp.SE50/110 cultivated in different growth media[J].Journal of Biotechnology,2013,167(2):166-177.
[17]LEE J S,HAI T,PAPE H,et al.Three trehalose synthetic pathways in the acarbose-producing Actinoplanes sp.SN223/29 and evidence for the TreY role in biosynthesis of component C[J].Applied Microbiology and Biotechnology,2008,80(5):767-778.
[18]NAKAE S,ITO S,HIGA M,et al.Structure of novel enzyme in mannan biodegradation process 4-O-β-d-mannosyl-d-glucose phosphorylase MGP[J].Journal of Molecular Biology,2013,425(22):4468-4478.
[19]HEMKER M,STRATMANN A,GOEKE K,et al.Identification,cloning,expression,and characterization of the extracellular acarbose-modifying glycosyltransferase,AcbD,from Actinoplanes sp.strain SE50[J].Journal of Bacteriology,2001,183(15):4484-4492.
[20]张琴,胡海峰,朱宝泉.阿卡波糖产生菌的选育和发酵工艺优化[J].中国医药工业杂志,2008(11):820-822.
[21]黄建平,郑燕.阿卡波糖产生菌的选育和发酵工艺优化[J].科技与创新,2018(18):134-135.
[22]牛鑫淼.阿卡波糖产生菌基因组重排育种[D].杭州:浙江工业大学,2019.
[23]周健.阿卡波糖高产菌株选育及分子改造[D].芜湖:安徽工程大学,2024.
[24]WOLF T,GREN T,THIEME E,et al.Targeted genome editing in the rare actinomycete Actinoplanes sp.SE50/110 by using the CRISPR/Cas9 System[J].Journal of Biotechnology,2016,231:122-128.
[25]李振鑫.阿卡波糖生产菌的基因改造及发酵工艺优化[D].上海:中国医药工业研究总院,2023.
[26]解慧欣,赵芹芹,白林泉.麦芽糖及转运蛋白对游动放线菌生产阿卡波糖的影响[J].基因组学与应用生物学,2019,38(10):4536-4544.
[27]解慧欣.阿卡波糖高产机制解析及菌株改造[D].上海:上海交通大学,2020.
[28]张欣,赵芹芹,白林泉.游动放线菌Actinoplanes sp.SE50/110阿卡波糖胞外代谢相关基因功能的初步研究[J].基因组学与应用生物学,2022,41(5):1006-1016.
[29]LI Z X,YANG S B,ZHANG Z Y,et al.Enhancement of acarbose production by genetic engineering and fed-batch fermentation strategy in Actinoplanes sp.SIPI12-34[J].Microbial Cell Factories,2022,21(1):240.
[30]王雅丽.阿卡波糖生产菌株Actinoplanes sp.SE50/110基因组规模代谢网络模型的构建与应用[D].无锡:江南大学,2015.
[31]ZHAO Q Q,XIE H X,PENG Y,et al.Improving acarbose production and eliminating the by-product component C with an efficient genetic manipulation system of Actinoplanes sp.SE50/110[J].Synthetic and Systems Biotechnology,2017,2(4):302-309.
[32]余贞,李美红,李娜,等.游动放线菌8-22中treY基因敲除对于降低阿卡波糖C组分的作用[J].微生物学通报,2015,42(7):1301-1306.
[33]N魻LTIN G S,M魧RZ C,JACOB L,et al.The 4-α-glucanotransferase AcbQ is involved in acarbose modification in Actinoplanes sp.SE50/110[J].Microorganisms,2023,11(4):848.
[34]LI K T,WEI S J,HUANG L,et al.An effective and simplified scale-up strategy for acarbose fermentation based on the carbon source control[J].World Journal of Microbiology and Biotechnology,2012,28(2):749-753.
[35]高敬红,何建勇,田威,等.碳源物质对阿卡波糖生物合成的影响[J].沈阳药科大学学报,2004(5):385-388.
[36]LEE S,EGELKROUT E.Biosynthetic Studies on the.ALPHA.-Glucosidase Inhibitor Acarbose in Actinoplanes sp.:Glutamate is the Primary Source of the Nitrogen in Acarbose.[J].The Journal of Antibiotics,1998,51(2):225-227.
[37]陈喆明.阿卡波糖发酵生产工艺研究[D].杭州:浙江工业大学,2018.
[38]郑鲁霞.Actinoplanes utahensis阿卡波糖合成途径分析及改造[D].福州:福州大学,2021.
[39]CHOI B T,SHIN C S.Isolation and characterization of a novel intracellular glucosyltransferase from the acarbose producer Actinoplanes sp.CKD485-16[J].Applied Microbiology and Biotechnology,2004,65(3),273-280.
[40]XUE Y P,QIN J W,WANG Y J,et al.Enhanced production of acarbose and concurrently reduced formation of impurity C by addition of validamine in fermentation of Actinoplanes utahensis ZJB-08196[J].BioMed Research International,2013,2013:1-9.
[41]SUN L H,LI M G,WANG Y S,et al.Significantly enhanced production of acarbose in fed-batch fermentation with the addition of S-adenosylmethionine[J].Journal of Microbiology and Biotechnology,2012,22(6):826-831.
[42]周鲁瑾,何志勇,陈喆明,等.高纯度阿卡波糖的制备方法[P].2007-08-01.
[43]LI K T,ZHOU J,WEI S J,et al.An optimized industrial fermentation processes for acarbose production by Actinoplanes sp.A56[J].Bioresource Technology,2012,118:580-583.
[44]任飞.产阿卡波糖放线菌的选育、发酵条件优化及代谢调控研究[D].无锡:江南大学,2018.
[45]姜玮,生英涛,蔡月明,等.麦芽糖浓度和渗透压对游动放线菌生长及阿卡波糖生物合成的综合影响[J].中国医药工业杂志,2010,41(3):178-182.
[46]CHENG X,PENG W FU,HUANG L,et al.A novel osmolality-shift fermentation strategy for improving acarbose production and concurrently reducing byproduct component C formation by Actinoplanes sp.A56[J].Journal of Industrial Microbiology and Biotechnology,2014,41(12):1817-1821.
[47]王子宝.优化通气及搅拌模式提升阿卡波糖发酵水平[J].化工设计通讯,2020,46(10):42-43.
[48]黄建平,郑燕.阿卡波糖发酵代谢阶段性溶氧控制的研究与应用[J].中国现代应用药学,2020,37(17):2114-2118.
[49]蔡成平.阿卡波糖产生菌的改良及发酵工艺优化[D].杭州:浙江工业大学,2018.
[50]魏淑梅,陈光,田威,等.阿卡波糖补料发酵工艺的研究[J].中国新药杂志,2008(11):923-926.
[51]俞晓芸,李娜,高双玉.一种提升阿卡波糖发酵水平的补料控制方法[J].发酵科技通讯,2023,52(4):191-195.
文章出自SCI论文网转载请注明出处:https://www.lunwensci.com/ligonglunwen/81759.html