摘要:蛋白质二硫键异构酶(Protein disulfide isomerase,PDI)作为一类多功能氧化还原酶,参与蛋白质合成、折叠和修饰等多个过程。最新研究表明,酵母和哺乳动物体内的PDI与内质网甘露糖苷酶协同作用,参与一种特殊的内质网相关降解(Endoplasmic reticulum associated degradation,ERAD)途径,该途径通过修剪N-糖链上的甘露糖可以实现对错误折叠糖蛋白的处理。尽管研究人员已经从拟南芥(Arabidopsis thaliana)中鉴定出14种PDI,但它们是否参与植物ERAD过程及其作用机制尚不明晰。文章旨在探讨酵母、哺乳动物和植物中PDI家族的结构与功能,并着重讨论其氧化还原活性在与其他蛋白质相互作用过程中的重要性,以及PDIs与EDEMs复合体在植物中的保守性。当前的研究不断深入对PDI家族的认知,旨在逐渐揭示其多样性与复杂性,为理解蛋白质质量控制和错误折叠蛋白降解提供新的视角。
关键词:PDI,ERAD,α1,2-甘露糖苷酶
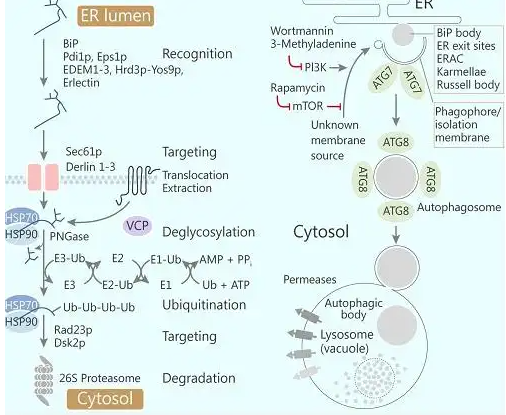
内质网(Endoplasmic reticulum,ER)在蛋白质的合成与折叠中发挥着核心作用,也是质量控制的中心。不完全折叠或错误折叠的蛋白质往往由内质网相关蛋白质降解系统(Endoplasmic Reticulum Associated Degradation,ERAD)进行清除。ERAD是一套高度保守且复杂的机制,可通过识别、定位和降解错误折叠的蛋白质,保持内质网的稳态[1]。蛋白质二硫键异构酶(Protein disulfide isomerase,PDI)家族是一组广泛分布于内质网中的氧化还原酶,参与蛋白质的折叠、修复和结构调整。近年来的研究表明,PDI不仅是一种折叠催化剂,还在ERAD过程中发挥着关键作用。但其在植物ERAD中的具体角色和作用机制仍有待阐明。
1蛋白质二硫键异构酶概述
PDI是一类具有酶和分子伴侣双重功能的氧化还原酶,可以通过催化二硫键的形成和重排,帮助蛋白质达到正确的构象。新生蛋白质在内质网的氧化折叠过程中,半胱氨酸残基之间二硫键的形成是关键限速步骤,而PDI家族的许多成员都能够催化这一过程。此外,PDI还会参与蛋白质的修复和ERAD过程。
典型的PDI主要包含4个类硫氧还蛋白(Thioredoxin,Trx)结构域,其中a和a'结构域负责控制氧化还原活性,b与b'结构域能够帮助底物结合并稳定a结构域。此外,末端酸性c区域对PDI的定位发挥着重要作用,同时某些PDI所特有的D结构域可用于特定的相互作用和底物识别。PDI家族成员呈现出了不局限于a-a’-b-b’经典结构域的不同组合排列,表明PDI出现了适应环境的功能分化。此外,PDI的多样性和复杂性还体现其定位上。植物中的大多数PDI都带有内质网定位信号,但不仅定位于内质网,还定位于叶绿体、高尔基体等其他细胞器中[2]。
关于酿酒酵母中PDI的研究较为深入,目前已发现5个PDI家族蛋白。相比之下,哺乳动物中的PDI家族更为庞大复杂,至少已发现21个家族成员,它们在内质网中对底物的氧化折叠发挥着不同功能。但当前关于植物的相关研究较为少见,从模式植物拟南芥中鉴定出了14个PDI成员,其被归类为不同结构的六个亚家族,它们对蛋白质折叠和氧化也发挥着多样化功能[2]。
2 PDI在ERAD中的作用
2.1 PDIs参与错误折叠蛋白的甘露糖修饰作用
2.1.1酵母Htm1与Pdi1的共价作用
ERAD途径精准识别目标底物不仅涉及多肽的折叠状态,还取决于其N-糖基化状态。酵母Mns1/Htm1为内质网定位的α1,2-甘露糖苷酶,具有MH结构域和保守的CT结构域。Mns1负责剪切N-糖B分支末端的α1,2-甘露糖残基,Htm1负责剪切C分支末端的甘露糖残基,从而释放降解信号,标志着蛋白质已进入ERAD通路。研究表明,Htm1具有体内活性,但并不与错误折叠蛋白直接结合,而是通过其CT结构域与Pdi1的b’结构域形成二硫键并结合在一起,将Htm1招募到Pdi1的底物上,引起构象变化并激活酶活性,剪切N-连接的Man8GlcNAc2糖。Pdi1-Htm1复合物已在体内外实验中证明了其具有优先识别和靶向错误折叠蛋白的特性。
2.1.2哺乳动物PDIs与EDEMs的共价作用
哺乳动物中Mns1/Htm1的同源蛋白有ERMan1、EDEM1-3。其中,EDEM2是负责B分支修剪反应的主要琢1,2-甘露糖苷酶,修饰N-聚糖生成M8B;而后EDEM 1/3优先修饰C分支的甘露糖残基,形成具有琢1,6-Man残基的M7、M6和M5聚糖(脊椎动物中为Man5GlcNAc2或Man6GlcNAc2),随后被凝集素识别进入ERAD。
研究发现,ERdj5能够增强EDEM1的活性,首次揭示了哺乳动物中PDI-EDEM的相互作用机制,为后续研究PDI结合对EDEM酶活性的重要作用奠定了重要基础。ERdj5/JPDI是哺乳动物中最大的PDI家族成员,携带有一个DnaJ结构域及六个Trx结构域。在糖蛋白降解途径中,EDEM1与ERdj5的C端结合,ERdj5还原错误折叠蛋白的二硫键,促进底物降解。
EDEM2是启动ERAD途径的关键酶,而体外纯化的EDEM2具有低甘露糖苷酶活性。Timms等通过鉴定EDEM2与TXNDC11的结合情况,发现其Trx5结构域的Cys692与EDEM2的Cys558形成盐桥[3-4]。这种稳定的连接是EDEM2将M9转化为M8B的必要条件。不同于ERdj5通过减少底物本身的二硫键来加速ERAD,TXNDC11被认为是EDEM2的活性开关,它通过激活EDEM2的甘露糖切割活性来打开ERAD通路。
类似的,体外单独表达的EDEM3本身并不具备甘露糖活性,却通过质谱分析成功鉴定了EDEM3的特异性结合伙伴ERp46—一种ER驻留的PDI。其与EDEM3的相互作用依赖于氧化还原活性位点,即ERp46的Cys残基与EDEM3中的Cys83和Cys442形成共价键相互作用,以实现对甘露糖酶切割活性的表达,调节EDEM3对底物甘露糖的修剪。
综上所述,与酵母中甘露糖的切割机制一致,哺乳动物中EDEM的催化活性依赖于其与PDI家族成员形成二硫键介导的复合物,该复合物可能识别并结合错误折叠糖蛋白或改变糖蛋白的构象,以最大限度地提高ERAD的效率[5]。
2.1.3植物中PDIs与EDEMs的作用机制
目前对于植物中PDIs与EDEMs之间的互作关系尚未有确凿的实验证据,但我们大胆猜测这一模式是保守的。以拟南芥为例,其基因组编码Htm1/EDEM的同源物分别为MNS4、MNS5,它们参与产生保守的N-聚糖ERAD信号。近期研究表明,两者之间存在功能分化的可能性,但其作用机制仍需进行深入探究。
研究发现,PDI11的D结构域与CRT1的P结构域相互作用,促进糖蛋白二硫键的形成与折叠;而PDI11的两个活性a、a’结构域的功能仍不清楚,这一发现为PDI与EDEM的互作提供了参考。酵母/哺乳动物PDI-EDEM复合体参与甘露糖修饰过程。类似的,拟南芥PDI11或其他PDI家族蛋白是否与MNS4、MNS5存在特异性结合,是否通过二硫键稳定结合形成复合体,以及是否通过识别末端错误折叠的糖蛋白或改变ERAD底物的构象以促进MNS4、MNS5的催化活性,都是亟须解答的问题。因此,需要通过更多实验研究来揭示这些相互作用的分子机制[6]。
3.2 PDIs参与ERAD通路其他相互作用
PDIs在ERAD通路中的作用不仅限于其与EDEMs的相互作用,其还参与了多个关键步骤,包括聚糖的加工、糖蛋白的质量控制以及ERAD的靶向[5]。除了EDEMs,ERAD通路还包括E1激活酶、E2结合酶、E3连接酶等分子,PDI与这些分子的相互作用可能涉及信号传导、底物选择和酶催化等多个层面。
3结论与展望
PDI通过其氧化还原能力参与ERAD通路中的多个关键环节,不仅帮助错误折叠蛋白恢复到可被ERAD识别和降解的状态,还能够通过与分子伴侣协同工作,引导其进入ERAD通路。酵母、哺乳动物以及植物中的PDI与Htm1/EDEMs通过二硫键形成共价复合体来启动ERAD过程,这一发现为PDI与其他ER蛋白之间通过共价键形成蛋白质-蛋白质相互作用,解释ER动态过程以及理解PDI的功能提供了新的思路。
随着研究的逐渐深入,不断有新PDI蛋白被发现,这使其功能研究变得更加复杂了[2]。同时,植物中PDI与ERAD通路关系的研究尚处于起步阶段,PDI在ERAD通路中的具体功能尚未完全阐明。植物中的PDI蛋白在ERAD中分别发挥哪些功能,是否存在其他未知的PDI参与ERAD,哪些PDI与Htm1/EDEMs同源物形成复合体识别错误折叠蛋白促进其降解,或者PDI还会与哪些ERQC、ERAD通路中的组分相互作用,这些问题都有待阐释。更重要的是,对植物中PDI蛋白在生物及非生物胁迫下的作用及其机理的研究可能会为提高生物抗逆性提供新途径。因此,有必要加快对PDI与ERAD之间关系的深入研究,以进一步阐明内质网蛋白质质量控制网络和错误折叠蛋白降解系统的调节机制,揭示这些复杂生物学过程中的更多细节。
参考文献
[1]BERNER N,REUTTER K R,WOLF D H.Protein quality control of the endoplasmic reticulum and ubiquitin proteasome-triggered degradation of aberrant proteins:yeast pioneers the path[J].Annual Review of Biochemistry,2018,87(1):751-782.
[2]陈珍,江琼,朱诚.植物中的蛋白质二硫键异构酶及其类蛋白[J].植物生理学报,2013,49(8):715-721.
[3]T R T,A S M,A I T,et al.Genetic dissection of mammalian ERAD through comparative haploid and CRISPR forward genetic screens[J].Nature Communications,2016,7(1):11786.
[4]GINTO G,SATOSHI N,HIROKAZU Y,et al.EDEM2 stably disulfide-bonded to TXNDC11 catalyzes the first mannose trimming step in mammalian glycoprotein ERAD[J].ELife Sciences,2020,9:e53455.
[5]PATEL C,SAAD H,SHENKMAN M,et al.Oxidoreductases in glycoprotein glycosylation,folding,and ERAD[J].Cells,2020,9(9):2138.
[6]ZHANG J J,WU J R,LIU L C,et al.The crucial role of demannosylating asparagine-linked glycans in ERADicating misfolded glycoproteins in the endoplasmic reticulum[J].Frontiers in Plant Science.2021,11:625033.
文章出自SCI论文网转载请注明出处:https://www.lunwensci.com/ligonglunwen/81658.html