摘要:文章采用溶剂热法制得Fe3O4纳米颗粒,并使用二水合柠檬酸钠对其进行表面改性,同时利用Stober水解法在其表面生成SiO2包覆层,得到粒径均一的超顺磁性Fe3O4 SiO2颗粒,并将其应用于尿液DNA提取。实验采用场发射扫描电镜(SEM)、红外光谱仪(FT-IR)、振动磁强计(VSM)和电感耦合等离子体发射光谱仪(ICP-OES)对微球进行表征处理,并用超微量分光光度计测定核酸量和纯度。结果表明,Fe3O4 SiO2粒径均匀,表面包覆良好,且耐腐蚀性极好;提取尿液DNA,测得A 260/A 280达1.87,其纯度可满足后续的PCR要求。与共沉淀法得到的磁珠相比,溶剂热法具有磁珠用量少、不易沉降、提取率高以及DNA提取纯度高等优点。
关键词:磁性微球,溶剂热,硅包覆,尿液,DNA提取
超顺磁性的纳米磁性材料具有悬浮性好、表面积大、易分散、吸附能力强等优点,在磁记录、磁流体、生物医学、吸附材料等领域具有广泛的应用前景[1-2]。其中,超顺磁性的Fe3O4纳米颗粒尤受关注,但未经表面修饰的Fe3O4纳米颗粒亲水性差、易团聚,表面缺少活性基团,无法满足生物医学的应用要求。因此,需要用特定材料包覆形成特定功能的核壳结构。其中,SiO2包覆材料具有无毒无害、亲水性好、耐酸碱、表面富含硅羟基、生物相容性良好,以及易于实现表面功能化等优点,可充当Fe3O4纳米颗粒的表面包覆材料[3-5]。
在Fe3O4 SiO2包覆过程中,易发生Fe3O4纳米颗粒团聚以及SiO2单独成核的现象。因此,本研究通过在包覆前对纳米Fe3O4粒子进行表面修饰来减少该类现象。研究先采用溶剂热法[6]制得Fe3O4纳米颗粒,再由二水合柠檬酸钠对其进行表面改性,最后利用Stober水解法[7]在其表面生成一层无定型SiO2包覆层,从而得到磁性Fe3O4 SiO2纳米颗粒[7]。
尿液中的DNA主要来自尿道中脱落的细胞。用尿液DNA进行分子生物学基础研究和临床诊断具有以下优点:1)尿液收集属于非介入、无创伤性活动;2)从尿液中提取DNA要比从血液中提取DNA更简单。提取的DNA可用于尿路肿瘤检查、PCR分析、DNA甲基化检测、微生物检测等[8-10]。本研究中,采用溶剂热法合成的磁性Fe3O4 SiO2纳米颗粒粒径均匀、饱和磁化强度高、表面羟基数量多,特别适用于尿液DNA提取。与共沉淀法合成的磁珠相比,溶剂热法具有磁珠用量少、不易沉降、提取率高,以及DNA提取纯度高等优点。
1材料与方法
1.1试剂与原料
乙二醇;无水乙酸钠;FeCl3·6H2O;无水乙醇;二水合柠檬酸钠;正硅酸乙酯;氨水。以上试剂均为分析纯。尿液为同事提供;尿液DNA提取试剂盒由广州康立明生物科技股份有限公司提供。
1.2 Fe3O4 SiO2纳米颗粒的合成
量取140 mL乙二醇,加入25 mmol的FeCl3·6H2O,超声混匀,加入65 mmol无水乙酸钠,超声混匀后置于水热反应釜中,200℃反应8 h,冷却至室温后,将产物用磁铁收集至烧杯中,用无水乙醇洗涤3次。将室温下干燥得到的Fe3O4纳米颗粒溶解到100 mL纯水中,加入一定量的二水合柠檬酸钠,超声混匀,通入氮气并接通冷凝水,60℃水浴搅拌7 h,取出并用纯水洗涤3次。将经过修饰的Fe3O4纳米颗粒加入100 mL纯水中,超声混匀,通入氮气并接通冷凝水,50℃水浴搅拌,再加入4 mL氨水,达到一定温度后使用恒压滴液漏斗滴加一定量的正硅酸乙酯混合液,滴加速度为3~6 s/滴,反应12 h后取出,用无水乙醇洗涤3次,最后于室温下干燥,得到磁性Fe3O4 SiO2纳米颗粒。
1.3尿液DNA的提取
取120 mL尿液3 000 g离心5 min,去掉上清液,得到尿液沉渣;加入0.5 mL洗涤液(尿液DNA提取试剂盒中有配备)清洗尿液沉渣,并转移至2 mL离心管中,10 000 g离心2 min;去掉上清液,再加入1 mL洗涤液,振荡混匀,10 000 g离心2 min,再缓慢去掉上清液,得到尿液DNA样本。
使用尿液DNA提取试剂盒中的各试剂,按照说明书对样本进行DNA提取。其中,磁珠分别为用自制溶剂热法合成的Fe3O4 SiO2磁珠,试剂盒中配备的用共沉淀法生产的磁珠。
1.4 DNA分析检测
取2μL提取得到的DNA,用超微量分光光度计测定其浓度和纯度。
1.5表征方法
采用激光粒度仪(英国马尔文公司)测试样品的粒度分布;采用扫描电镜(SEM,日本电子公司)测试样品的微观形貌;采用红外光谱仪(FT-IR,布鲁克公司)分析样品的官能团;采用电感耦合等离子体发射光谱仪(ICP-OES,美国安捷伦公司)分析样品的耐酸性;采用超微量分光光度计(NanoDrop One,赛默飞世尔科技公司)测定样品的浓度和纯度。
2结果
2.1 SEM与VSM结果对比
SEM结果显示,本研究采用溶剂热法合成的磁性微球球形度好、粒径分明且大小均一,具体如图1(a)所示;共沉淀法得到的磁性微球则由几十纳米的氧化铁团簇聚集而成,分散性不好且易沉淀,具体如图1(b)所示。
溶剂热法和共沉淀法合成磁珠的磁滞回线测试结果显示,其饱和磁化强度值分别为56.25 emu/g和30.99 emu/g,表明溶剂热法制得的磁珠的磁化强度高于共沉淀法制得的磁珠,且剩磁均接近于零,具有很好的超顺磁性。
2.2 SiO2包覆对Fe3O4颗粒的影响
对包覆前后的微粒进行马尔文粒度测试,结果显示,刚制备得到的裸磁性Fe3O4颗粒有多个峰出现,而经过SiO2包覆后的磁性Fe3O4颗粒只有一个峰,且呈单分散性。这表明,表面包覆SiO2能够提高微粒的分散性。
研究发现,采用溶剂热法制备的没有进行表面修饰的磁性Fe3O4颗粒,团簇粒子呈规则球状,且球形度良好,粒径均匀,但分散性不好,存在团聚现象,如图2(a)所示;最后得到的磁性Fe3O4 SiO2颗粒,粒子球形度好,粒径均一,且分散性很好,如图2(b)
2.3 FT-IR光谱分析
采用溶剂热法制备的Fe3O4纳米颗粒及Fe3O4 SiO2颗粒的红外光谱图如图3所示。与文献对比可知,Fe3O4 SiO2在1 225 cm-1和1 084 cm-1处有很强的吸收峰,对应的是Si-O-Si的不对称伸缩振动;951 cm-1处的吸收峰为Si-OH的伸缩振动;802 cm-1处的吸收峰为Si-O-Si的对称伸缩振动;469 cm-1处尖锐的吸收峰为Si-O-Si或O-Si-O的弯曲振动;而444、591、629 cm-1处的吸收峰对应的是Fe-O的弯曲振动。对比结果进一步表明在Fe3O4颗粒表面形成了SiO2[11]。
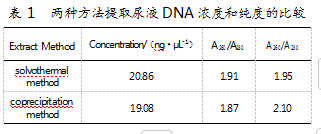
2.4尿液DNA提取的结果
实验分别使用由溶剂热法(solvothermal method)和共沉淀法(coprecipitation method)制得的磁珠对尿液进行DNA提取,并使用超微量分光光度计对提取到的DNA进行浓度和纯度测试。结果如表1所示。
3讨论
3.1 FeCl3·6H2O的加入量对Fe3O4颗粒粒径的影响
在溶剂热法工艺中增大原料FeCl3·6H2O的添加量,由20 mmol增加到30、46、54 mmol,发现粒径明显变大,如图4(a)的d(0.5)=0.464μm、图4(b)的d(0.5)=0.548μm,粒径均一性也随之变差;添加量继续增加,粒径均一性会急剧下降,如图4(c)、(d)所示。这是因为原料加入量过大会使反应刚开始形成的Fe3O4团簇在溶剂中的分散密度提高,导致Fe3O4团簇间相互碰撞融合的概率增加,进而形成更大粒径的Fe3O4颗粒[6-7]。
3.2 SiO2包覆对Fe3O4颗粒耐酸性的影响
将Fe3O4和Fe3O4 SiO2颗粒分别分散在1 mol/L的HCl溶液中。添加Fe3O4颗粒的溶液2 h后变成透明的黄绿色,Fe3O4颗粒完全溶解消失;添加Fe3O4 SiO2颗粒的溶液,反应0、2、4、8 h后使用ICP-OES测得离心后上清液中的铁含量质量占比在百万分之0.42~0.55之间,没有显著增加。这说明Fe3O4外表面包覆了SiO2层,而SiO2壳层阻断了核心Fe3O4与HCl溶液的接触,使其无法发生反应。这说明在酸性条件下SiO2对磁性Fe3O4起到了很好的保护作用,提高了其耐酸性。
图2(b)(c)(d)为最后得到的磁性Fe3O4 SiO2颗粒,说明SiO2包覆在磁性Fe3O4颗粒表面可有效屏蔽磁力作用,较好地改善其在水和乙醇中的分散性。图2(b)为加入0.7 mL正硅酸乙酯得到的电镜图;图2(c)为加入1 mL正硅酸乙酯得到的电镜图;图2(d)为加入1.4 mL正硅酸乙酯得到的电镜图。从中可知,加大正硅酸乙酯的加入量能够提升颗粒的分散性。同时实验发现,过度加入正硅酸乙酯容易产生灵粒团聚现象,这是因为过量正硅酸乙酯易在颗粒表面成核,且长大形成SiO2微球。
研究发现,采用溶剂热法提取到的DNA的浓度和纯度均优于共沉淀法的提取成效,这是因为使用溶剂热法得到的磁珠分散性、表面包覆性、悬浮性均优于使用共沉淀法得到的磁珠。后续尝试采用溶剂热法制备磁珠,将溶剂使用量减半,发现提取浓度和纯度没有降低。
4结论
通过溶剂热法合成的Fe3O4 SiO2微球球形度好、粒径均匀、表面包覆良好,且有良好的耐腐蚀性。用其提取尿液DNA,提取浓度高,且A 260/A 280达到了1.87,纯度可满足后续的PCR要求。与共沉淀法相比,溶剂热法具有磁珠用量少、不易沉降、提取率高以及提取的DNA纯度高等优点。
参考文献
[1]KUMAR N,PURI P,SHARMA D,et al.Comparison of two DNA extraction Methods and their Utility in Forensic examination of Bone samples[J].Medico-Legal Update,2018,18(2):94-99.
[2]XIAO Y,WANG H C,LI X,et al.Research on Magnetic Separation Methods for the Extraction of Nucleic Acids[J].Advanced Materials Research,2013,2290(662):343-347.
[3]徐冬冬,黄花.尿液游离DNA检测及其在肿瘤诊治中应用的研究进展[J].现代肿瘤医学,2021,29(13):2347-2350.
[4]邓海月,王聪,王晓媛,等.男性X连锁Alport综合征COL4A5突变嵌合体病例报道及文献复习[J].中华肾脏病杂志,2021,37(11):865-871.
[5]杨秋萍,李小红,闻娟,等.一例红细胞生成性原卟啉病临床分析及FECH基因检测[J].中国麻风皮肤病杂志,2021,37(4):193-197.
[6]GENG M X,LIU F T.Preparation of Fe3O4 nanoparticles by hydrothermal method[J].Journal of University of Jinan,2009,8(4):401-404.
[7]王雅凡,黄艳凤,杨华,等.制备硅包覆的磁性微球用于蓖麻叶DNA的提取[J].现代生物医学进展,2010,10(17):3205-3208.
[8]孙宁,张佳林,周翔宇,等.应用磁珠法检测并提取尿液游离甲基化DNA[J].中国医科大学学报,2015,44(10):897-900.
[9]俞丽娟,路志勇,焦章平,等.激光显微捕获技术用于尿液脱落细胞DNA检测[J].中国法医学杂志,2011,26(05):359-361,433-434.
[10]蒋娜,汪崇文,周标,等.一种高性能磁性复合微球的制备及其在DNA提取中的应用[J].军事医学,2016,40(6):520-524.
[11]SUN J,YU G,LIU L.Core-shell structured Fe3O4 SiO2 supported cobalt(Ⅱ)or copper(Ⅱ)acetylacetonate complexes:magnetically recoverable nanocatalysts for aerobic epoxidation of styrene[J].Catalysis Science&Technology,2014,4(5):1246-1252.
文章出自SCI论文网转载请注明出处:https://www.lunwensci.com/ligonglunwen/81656.html