摘要:文章通过分析CSN5效应蛋白,为印度梨形孢与植物互作研究提供了新的思路和方向,有助于深入探究相关问题。同时,采用生物信息学软件Protpapram、ProtScale、NCBI-CD-search等预测了CSN5的主要特性。CSN5蛋白由369个氨基酸组成,为稳定亲水性蛋白,且其特异性保守结构域属于Mov34/MPN/PAD-1家族。生物信息学分析表明,CSN5蛋白保守性较强,能够与多种蛋白相互作用去泛素化,为效应蛋白提高植物抗逆性奠定了基础。
关键词:印度梨形孢,效应蛋白,生物信息学
印度梨形孢(Piriformospora indica)是由Verma等[1]于1998年在印度西北部的塔尔沙漠中发现的一种可培养的内生真菌。真菌寄生在植物体内会分泌一系列效应蛋白,而这些蛋白可进入寄主细胞,并转运到植物根细胞膜外发挥作用,促进寄主植物的免疫反应。印度梨形孢中含有500多个不同基因编码的分泌蛋白,其中,多数效应蛋白易变异,不能稳定增强植物对逆境胁迫的抗性,但也有一部分保守效应蛋白能够稳定地与植物互相作用,提高作物产量及免疫抗性[2]。张正光团队发现了具有高度保守性的毒效应蛋白。将其作用于该靶点可以有效防治稻瘟病[3],成为新的抗病育种材料或发展新的生物防治手段。
Barth等[4]在拟南芥中发现了候选枢纽蛋白中的效应蛋白CSN5具有高度保守的特点,且植物与动物氨基酸序列的相似度约为60%。Dohmann等[5]发现,CSN通过与拟南芥中赤霉酸信号传导途径中的SCF SLY1 E3泛素连接酶相互作用,可以调节多种植物激素的信号传导,这说明CSN5蛋白可以调节植物的激素信号传导。然而,PIIN分泌的CSN5作为保守效应蛋白,在植物体内相互作用的靶标蛋白的定性及其功能发挥的作用机制尚不明确。因此,利用生物信息学方法揭示效应蛋白CSN5调控植物免疫分子的机理具有重要的研究意义。
1材料与方法
1.1蛋白质序列下载
登录蛋白质数据库UniProt(https://www.uniprot.org/)网站获取印度梨形孢中CSN5的氨基酸序列(登录号为G4TL52)。经查询,CSN5蛋白由369个氨基酸组成,其序列如下:MALQTFSLSNDIVEVSPQ DEIYKYDAAADRQINNQSPWATDPHYFKSCRISAV ALIKMVIHARSGVPHEIMGLMQGKVVGQSLVIMDS FALPVQGTETRVNAANEANEYMVEYLESSKKVGRL ENAIGWYHSHPGYGCWLSGIDVNTQMTNQRYQDP FVAVVIDPNRTISAGKVDIGAFRTYPEDYKPPTSGK TDEYQSIPLSKIEDFGVHANSYYPLDVQIFKSTLDDT LLGLLWNKYWVNTLSQSPLISNRAYAVSQLQDLQA KLNKAKGSIPNTRASVPTAKATAPAGDSKAPPKRK DTTEEASTSKAKDEPKESALQKGVRDSTKLAMEAQ HGLISQALKEYIFGANQDVAQSLNVLNTAIATEK。
1.2 CSN5蛋白的主要特性预测
利用Protpapram(CSN5)软件预测CSN5蛋白的理化性质;利用ProtScale(http://web.expasy.org/protscale)分析CSN5蛋白的亲(疏)水性[6];运用WoLF PSORT(https://wolfpsort.hgc.jp/)在线工具预测CSN5蛋白的亚细胞定位;运用在线软件SOPMA(https://npsa-prabi.ibcp.fr/cgi-bin/npsa_automat.pl?page=/NPSA/npsa_sopma.html)预测CSN5蛋白的二级结构[7]。
1.3 CSN5蛋白的保守结构域分析
运用NCBI-CD-search(https://www.ncbi.nlm.nih.gov/Structure/bwrpsb/bwrpsb.cgi)预测CSN5蛋白的保守结构域。
1.4 CSN5蛋白系统进化分析
采用MEGA软件预测CSN5蛋白系统进化树,并通过iTOL(https://itol.embl.de/upload.cgi)美化工具进行美化。
1.5 CSN5蛋白的相互作用蛋白分析
运用STRING(http://string db.org/cgi/input.pl)软件预测CSN5的相互作用蛋白,以进一步解析CSN5的功能。
2结果
2.1 CSN5蛋白的主要特性分析
CSN5蛋白的分子式为C1799H2832N490O562S10,由369个氨基酸构成,相对分子质量为40 637.82,等电点pI为6.20。分析结果表明,CSN5蛋白包含20种氨基酸。其中,丙氨酸占比10.0%;丝氨酸占比8.7%;异亮氨酸占比7.3%,这3种氨基酸占比最大。Asp和Glu残基的负电荷总数为41;Arg和Lys残基的正电荷总数为38。CSN5蛋白不稳定性指数为44.14,平均亲水性为-0.424,脂肪族氨基酸指数为80.41。ProtScale软件预测得出CSN5蛋白为亲水性蛋白,且第301位氨基酸疏水性最强,为-2.867;第56位氨基酸亲水性最强,为2.533。
在线软件WoLF PSORT分析cyto得分为14.5;cyto_nucl得分为14;nucl得分为12.5,表明CSN5蛋白定位可能位于细胞质。
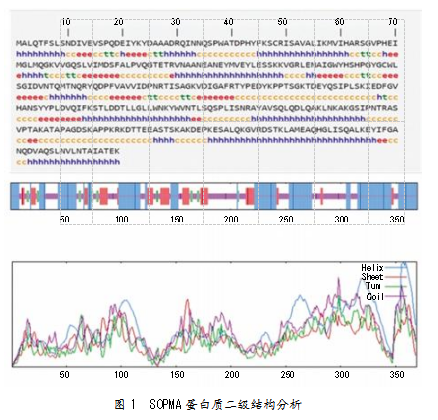
由SOPMA预测得到的CSN5蛋白的二级结构如图1所示。CSN5蛋白有4种类型:α-螺旋(Hh)161个,占比43.63%;β-转角(Tt)16个,占比4.34%;β-折叠(Ee)58个,占比15.72%;无规则卷曲(Cc)134个,占比36.31%。由此可见,该蛋白结构稳定。
2.2 CSN5蛋白保守结构域分析
CSN5蛋白的特异性保守结构域属于Mov34/MPN/PAD-1家族。Mov34/MPN/PAD-1家族包含标志性的JAB1/MPN/Mov34金属酶(JAMM)基序。该基序与锌指离子协作构成COP9信号复合体亚基5,并作为调节泛素化的通路(见图2)。
2.3 CSN5蛋白系统进化分析
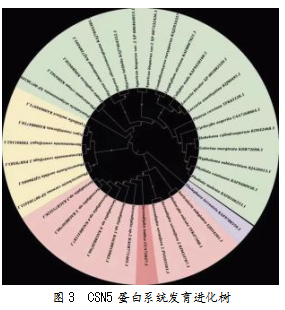
进化树分4大分支,目标蛋白所在分支的蛋白为内生担子菌COP9信号体催化亚基rri1的不同部分以及Mov34家族成员,具有去泛素化的作用,能对异常蛋白质降解起到调节作用,维持蛋白质的正常功能(见图3)。
2.4 CSN5蛋白质的相互作用网络预测
STRING在线分析预测显示,与CSN5蛋白相互作用的蛋白有PIIN_07839、PIIN_02592、PIIN_00265、PIIN_03177。这些蛋白分别属于COP9信号复合体1、2、4、6亚基,得分为0.999。PIIN_02460为ACOB蛋白,得分为0.999;PIIN_08677为PCI重组蛋白,得分为0.988;PIIN_06476为ubl1蛋白,得分为0.988;PIIN_02455为cullin 4A,得分0.974。上述蛋白与调节蛋白质降解、调控转录过程、调控细胞周期和泛素化通路有关。
3讨论
在受逆境胁迫的植物体内往往会出现泛素化异常的情况。植物会通过降解细胞质内蛋白和细胞器以求在营养匮乏的条件下实现基础营养物质的有效周转。因此,异常泛素化对调节植物的正常生长发育至关重要[8]。研究得出,CSN5蛋白的特异性保守结构域属于Mov34/MPN/PAD-1家族,而该家族的标志性JAMM基序是泛素调节通路的重要参与者。此外,PIIN中与CSN5蛋白相互作用的蛋白主要有COP9信号复合体1、2、4、6亚基、PCI重组蛋白、ubl1蛋白、cullin4A 4大类。底物泛素化的原因之一是Nedd8泛素化修饰因子发挥作用从而影响蛋白活性,而COP9信号复合体作为一个异肽酶,可以脱Nedd8修饰和磷酸化作用来影响蛋白降解[9]。ubl1蛋白是与泛素调节相关的重要蛋白,且其编码基因具有核酸外切酶的活性,若功能缺失会造成mRNA剪切障碍。上述分析预测得出,CSN5能够调节逆境下植物的信号传导和代谢等生物学过程。本文通过生物信息学得出了效应蛋白CSN5的分析结果,不仅为内生真菌与植物的相互作用等研究提供了参考,还为以效应蛋白为方向的生物农药研发提供了新思路。
参考文献
[1]VERMA S,VARMA A,REXER K H,et al.Piriformospora indica,gen.et sp.nov.,a new root-colonizing fungus[J].Mycologia,1998,90(5):896-903.
[2]毛琳琳,朱志炎,何勇,等.印度梨形孢(Piriformospora indica)与植物互作研究综述[J].安徽农学通报,2016,22(11):47-50,99.
[3]LIU M X,WANG F F,HE B,et al.Targeting Magnaporthe oryzae effector MoErs1 and host papain-like protease OsRD21 interaction to combat rice blast[J].Nature Plants,2024,10(4):618-632.
[4]EMANUEL B,RON H,ARIA B,et al.The Evolution of COP9 Signalosome in Unicellular and Multicellular Organisms[J].Genome Biology and Evolution,2016,8(4):1279-1289.
[5]DOHMANN N M E,NILL C,SCHWECHHEIMER C.DELLA proteins restrain germination and elongation growth in Arabidopsis thaliana COP9 signalosome mutants[J].European Journal of Cell Biology,2009,89(2):163-168.
[6]刘静,吴芳,张杰,等.结核分枝杆菌Rv1733c蛋白的生物信息学分析[J].中国病原生物学杂志,2021,16(3):274-281.
[7]徐锦凤,王震,易德武,等.布鲁氏菌ManB蛋白的生物信息学分析及免疫原性研究[J].农业生物技术学报,2018,26(2):311-318.
[8]LI B Y,NIU F F,ZENG Y L,et al.Ufmylation reconciles salt stress-induced unfolded protein responses via ER-phagy in Arabidopsis[J].Proceedings of the National Academy of Sciences,2023,120(5):e2208351120.
[9]LYAPINA S,COPE G,SHEVCHENKO A,et al.Promotion of NEDD8-CUL1 Conjugate Cleavage by COP9
文章出自SCI论文网转载请注明出处:https://www.lunwensci.com/ligonglunwen/81506.html