摘要:为了解引起人类疾病的大肠埃希菌O157:H7的致病基因差别,文章在一名无其他基础疾病的腹痛、腹泻患者肛拭子中,通过细菌表型和核酸RT-PCR结合的鉴定方法,分离出一株毒力基因缺陷型大肠埃希菌O157:H7,并对其毒力及药物敏感性进行分析。文章用Taq Man Array探针微流控芯片技术进行RT-PCR核酸检测,并对患者实施排除其他胃肠道致病菌和腹泻相关病毒的检测。研究发现,从该患者肛拭子中检测并分离出的一株基因缺陷型大肠埃希菌O157:H7仅携带eae毒力基因,不携带stx毒力基因,且菌株无耐药现象。然而,这种仅携带eae基因、不携带stx基因的基因缺陷型大肠埃希菌O157:H7,仍可引起人体较为严重的腹痛、腹泻临床症状,虽然病程相对较短,无严重致死性并发症,治疗相对容易。
关键词:大肠埃希菌,多重PCR,微流控芯片技术,基因缺陷型,eae基因,非耐药株
大肠埃希杆菌0157:H7(Escherichia coli O157:H7,简称E.coli O157:H7)感染,在全球范围内具有普遍性。在北美许多地区、该菌种数量排在肠道分离病原菌的第二或第三,是血便中能分离到的最常见菌,分离率占血便的40%[1]。我国自1987年以来,新疆、北京、江苏、山东、河南、安徽等地均发现了E.coli O157:H7的散发病例。人感染E.coli O157:H7的主要途径是食用或接触被污染的牛肉、牛奶、蔬菜、水果和水源等[2],且感染剂量极低,仅摄入5个活菌就有可能致病[3]。临床上对使用抗生素治疗E.coli O157:H7感染存在很大争议。某些抗生素被证实可有效治疗E.coli O157:H7的早期感染[4],但也有研究从环境和人体粪便样本中分离到E.coli O157:H7耐药菌株,并发现在早期感染阶段用抗生素治疗无效。因此,在治疗前,需要准确了解其抗生素抗性,否则极有可能导致毒素释放增加,病情恶化[5]。
在本文的这名无其他基础疾病的腹痛、腹泻患者肛拭子中,通过使用科玛嘉E.coli O157显色培养基平板和改良山梨醇麦康凯培养基(CT-SMAC)分离培养、利用VITEK2 Compact 15微生物生化鉴定仪生化检测、QuantStudio 7pro扩增仪,基于多重病原菌核酸进行RT-PCR检测及血清型别凝集试验,分离出一株基因缺陷型E.coli O157:H7(菌株编号DC-2024034)。同时,用致泻大肠埃希氏菌毒力基因多重RT-PCR对其进行毒力基因检测,并实施药物敏感实验分析。此外,还用Taq Man Array探针微流控芯片技术,对样本其他胃肠道致病菌和腹泻相关病毒进行核酸多重RT-PCR检测。
1材料
标本介绍:患者男性,10岁;主诉:腹部脐周绞痛、腹泻,腹泻频率为3~4 h一次,粪便性状为水样便,在症状出现第二天就诊;体征:血压90/70,心率75次/min,体温37.2℃,无其他基础疾病。采集患者肛拭子双份进行致病菌和腹泻相关病毒检测,并分离出一株基因缺陷型E.coli O157∶H7。
2方法
2.1主要培养基试剂及仪器
CT-SMAC培养基;科玛嘉E.coli O157显色培养基;MUG-LST培养基;TSI琼脂;O157∶H7大肠埃希氏菌诊断血清;E.coli O157∶H7多重PCR扩增试剂;致泻大肠埃希氏菌毒力基因PCR扩增试剂;Taq Man Array探针微流控芯片PCR扩增试剂;硕世细菌DNA和病毒提取试剂;VITEK®2 Com-pact微生物生化鉴定仪;QuantStudio 7pro扩增仪;硕世SSNP-9600A核酸提取仪;DL-96A药敏分析仪。
质控菌株:E.coli O157∶H7 ATCC12900,广东环凯微生物有限公司。
以上试剂均经质控菌株测试,结果良好。
2.2增菌培养
肛拭子无菌剪去手持部分,放入营养肉汤36℃培养6 h,后转至肠道增菌液肉汤42℃培养18 h。
2.3分离培养
用接种环挑取肠道增菌肉汤,分别划线接种科玛嘉E.coli O157显色培养基平板和CT-SMAC培养基平板,36℃培养24 h。分别选择科玛嘉E.coli O157显色培养基平板上圆形、光滑、中心紫色边缘灰色的小菌落和CT-SMAC培养基平板上圆形、光滑、较小且中心呈现较暗灰褐色的无色菌落,接种TSI琼脂、血琼脂,同时接种MUG-LST肉汤。分别用标准菌株大肠埃希氏菌株ATCC25922做阳性对照和E.coli O157∶H7 ATCC12900做阴性对照,36℃培养24 h。将MUG-LST肉汤管置于365 nm波长紫外灯下照射,显示菌株DC-2024034 MUG荧光阴性,且阴性、阳性对照管均结果良好易辨。在TSI琼脂中,斜面与底层均呈黄色,产气,不产H2S。
2.4菌种鉴定
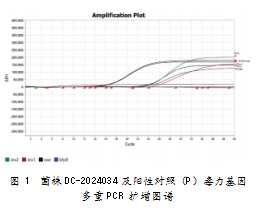
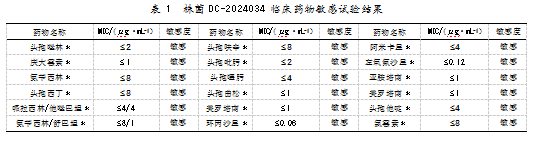
将上述菌株进行营养琼脂纯培养,并开展革兰染色和氧化酶实验,结果为革兰阴性、短小杆菌,氧化酶阴性。使用VITEK®2 Compact微生物生化鉴定仪表型鉴定;鉴定结果为E.coli O157。用E.coli O157∶H7诊断血清进行凝集实验,显示O157血清凝集为+++;H7血清凝集为+++。用硕世SSNP-9600A核酸提取仪、硕世提取试剂及QuantStudio 7pro扩增仪,实施E.coli O157∶H7多重PCR及致泻大肠埃希氏菌毒力基因多重PCR检测,显示菌株DC-2024034为仅携带eae毒力基因的毒力基因缺陷型E.coli O157∶H7。扩增图谱如图1所示。采用Taq Man Array探针微流控芯片技术,对检样进行其他胃肠道致病菌和腹泻相关病毒核酸RT-PCR检测,结果未检出其他胃肠道致病菌和腹泻相关病毒。用DL-96A药敏分析仪对检出菌株DC-2024034进行药敏实验,结果如表1所示。
3随访
对该患者进行随访,要求患者口服盐酸环丙沙星胶囊500 mg Bid,发现用药3天后腹痛、腹泻症状消失,且后期无其他并发症出现。
4结论
E.coli O157:H7可产生大量Vero毒素(VT-1和VT-2),也被称作志贺氏毒素(SLT),且主要与其携带的Stx基因有关。该毒素可使机体出现严重的炎症反应和组织学广泛损伤,严重时甚至还可能出现致死性的溶血性尿毒综合(Hemolytic uremic syn原drome,HUS)、血小板减少性紫癜(thromboticthrom原bocytopenicpurpura,TTP)以及导致4岁以下儿童急性肾衰[1]。本文在该名无其他基础疾病的10岁儿童腹痛、腹泻患者的肛拭子中分离出的基因缺陷型E.coli O157:H7,不携带stx毒力基因,仅携带eae毒力基因,且在检样中未检出其他能引起腹痛、腹泻的致病菌及腹泻相关病毒。结果表明,eae毒力基因可作为E.coli O157:H7独立的致病基因,引起人体较重的腹痛、腹泻临床症状,但病程相对较短,一般不会出现严重致死性并发症。经药物敏感实验分析,该菌株未出现耐药现象,不属于耐药菌株,治疗相对容易。现有研究结果表明,由于携带毒力基因的菌株广泛存在于牛、羊等动物宿主中,动物宿主在感染暴发流行中起主要作用[6]。加强肉类及奶制品等食品的E.coli O157:H7检测、监测其毒力及抗生素抗性,以及了解E.coli O157:H7的遗传特征、致病机制和耐药性,是该疾病预防、控制、临床诊断及治疗的重要手段。
本文所得菌株仅携带的eae基因,是一种被称为紧密素(intimin),分子质量为94 kDa的外膜蛋白,主要用于编码黏附因子,具有较强黏附能力,是病原菌定居并对机体造成损害的重要因素。细菌通过菌毛可有力黏附在宿主的盲肠和结肠上皮细胞的刷状缘上,并使微绒毛损害脱落,引起病变效应。这也是该菌在人肠道黏膜定居并引起病变损伤的基础。该菌株具有较强传染性,在疾病流行过程中起主要作用。然而,该菌株stx毒力基因会由于某种原因丢失,从而成为毒力基因缺陷型的弱毒株。因此,在临床和食源性疾病监测中,大肠埃希菌往往会因不产生Vero毒素而不被重视。需要注意的是,该类菌株仅携带的eae毒力基因,具有极强传染性,易造成相关疾病的广泛流行。因此,在重视携带stx毒力基因菌株同时,也不可忽视对携带eae毒力基因的基因缺陷型E.coli O157:H7的监测,这对控制相关疾病流行有着重要意义。
同时,要加强群众的健康卫生知识宣传,特别是食品加热烧熟的重要性,不食生冷变质食品,不喝生水。在出现腹泻等症状时,应及早就诊,及时规范接受治疗,并在医生指导下使用抗生素。要让群众认识到不合理使用抗生素治疗E.coli O157:H7感染性腹泻,可能会导致毒素释放增加,加重病情,诱发急性肾功能衰竭等严重后果。
参考文献
[1]刘运德,楼永良,王辉.临床微生物学检验技术[M].北京:人民卫生出版社,2015.
[2]林鹭芳,黄健利,钟凌.漳州市首次检出O157:H7大肠杆菌[J].海峡预防医学杂志,2002(4):5
[3]吴家林,肖勇,凌霞,等.肠出血性大肠杆菌O157:H7多重PCR快速检测研究[J].现代预防医学,2009,36(1):117-119.
[4]KAKOULLIS L,PAPACHRISTODOULOU E,CHRA P,et al.Shiga toxin-induced haemolytic uraemic syndrome and the role of antibiotics:a global overview[J].Journal of In-fect,2019,79(2):75-94.
[5]MIR R A,KUDVA I T.Antibiotic-resistant Shiga tox-in-producing Escherichia coli:an Overview of prevalence and intervention strategies[J].Zoonoses Public Health,2019,66(1):1-13.
[6]程海卫,杨霞,赵军,等.动物源E.coli O157:H7 stx基因的检测与系统进化分析[J].中国畜牧兽医,2012,39 (10):173-180.
文章出自SCI论文网转载请注明出处:https://www.lunwensci.com/ligonglunwen/81333.html