摘要:聚磷菌(Phosphorus accumulating bacteria,PAOs)在生物除磷系统(EBPR)的强化过程中发挥着重要作用。挖掘新型高效聚磷菌并优化其除磷工艺,对于废水生物除磷技术的发展具有重大意义。文章通过富集驯化、分离纯化,结合MOPS蓝白斑(10×)初筛、Albert异染颗粒复筛等方法从某污水处理厂污泥样品中筛选出一株高效聚磷细菌G2,将其鉴定为盐生谷氨酸杆菌(Glutamicibacter halophytocola),并通过单因素试验探究pH、温度、接种量、初始磷含量,以及水体中的阳离子浓度对菌株G2生长及除磷的影响。实验结果表明,该菌株在初始磷浓度为30 mg/L、pH为8.0、8.0%接种量、32。C的条件下发酵72 h后,磷去除率可达78.79%。同时,添加2.0%的Mg2+可以将菌株G2在人工合成废水中的除磷率提高17.50%。文章所筛选出的盐生谷氨酸杆菌G2在人工合成废水中表现出了良好的除磷效果,有望为废水生物除磷技术提供优质菌种资源。
关键词:聚磷菌,分离鉴定,Glutamicibacter sp.G2,合成废水,除磷特性
磷作为水体富营养化诱发因子的概率高达67%[1],严格控制出水中磷含量的同时实现对磷资源的高效回收和再利用,有利于发展绿色经济[2]。生物除磷技术一直以来都被认为是有效抑制水体富营养化的重要途径[3],聚磷菌(PAOs)在生物除磷系统(EBPR)的强化过程中发挥着重要的作用[4-5]。有关聚磷菌的筛选研究指出,聚磷菌一般存在于传统活性污泥、沉积物、土壤等环境中[6],主要包括Ca.Accumulibacter和Tetrasphaera两个主要类群[7],如芽孢杆菌属(Bacillus sp.)[8]、假单胞菌属(Pseudomonas sp.)[9]、节杆菌(Arthrobacter sp.)[10]、微小杆菌属(Exiguobacterium sp.)[11]、假苍白杆菌属(Pseudochrobactrum sp.)[12]和解淀粉芽孢杆菌(Bacillus amyloliquefaciens)[13]等。聚磷菌的发现和应用推动了生物除磷技术的迅速发展,极大地提高了生物除磷效率。目前为止,优质聚磷菌种资源的挖掘、性能优良菌株的人工构建、应用效果的提升等研究仍然是该领域学者关注的重点。
在聚磷菌的筛选和改良技术得以迅速发展的同时,其实际应用效能也受到了广泛关注[14]。聚磷菌在其发酵过程中极易受溶氧、pH、温度、初始磷含量等因素影响,在实际应用中存在除磷效率不稳定、系统难以达到最优运行条件等问题,远远难以达到高效除磷的技术要求[15]。因此,挖掘新型高效聚磷菌株,并对其除磷机理及特性进行更深层次研究,对于生物除磷技术的发展具有重大意义。本文结合初筛、复筛、定量测定等技术从污泥样品中分离筛选出高效聚磷菌,并研究不同理化因素对其生长和除磷效率的影响,以期为拓展聚磷菌菌种库、进一步开发污水生物除磷技术提供优良的种质资源及理论基础,为降低工业、生活等污水的磷含量,以及优化水质作出实质性努力。
1试验材料和方法
1.1样品来源
试验样品采自石家庄某污水处理厂活性污泥,于-20。C的环境中冷冻保存备用。
1.2高效聚磷菌株的分离鉴定
本研究参照祁欣[16]、刘俞辰等[17]提出的方法,通过MOPS(10×)初筛、异染颗粒染色(Albert)复筛,以及聚磷能力定量验证等方法筛选高效聚磷菌株。菌株G2的菌落及菌体形态观察、生理生化特征试验分别参照《常见细菌系统鉴定手册》[18]和《伯杰氏细菌鉴定手册》[19]。试验进行菌株的16S rDNA分子生物学鉴定,同时基于全基因组水平利用EzBioCloud数据库开展平均核苷酸相似性分析(ANI),并对G2菌株的分类水平进行重新鉴定。
1.3生长曲线和聚磷曲线测定
将活化好的菌种以5%的接种量接种到聚磷专性培养基中,在28。C、180 r/min条件下振荡培养72 h。培养过程中注意定时定量取样,测定生长量OD600和发酵液磷含量,绘制生长曲线和聚磷曲线。
1.4聚磷菌G2的除磷特性
通过单因素试验探究初始磷浓度、pH、培养温度、接种量4个因素对菌株G2除磷性能的影响。分别设置初始P质量浓度:5.0、10.0、20.0、30.0、40.0、50.0和60.0 mg/L;培养温度:22.0、24.0、28.0、30.0、32.0、34.0、36.0和38.0。C;初始pH(用HCl和NaOH调节):4.0、5.0、6.0、7.0、8.0和9.0;接种量: 0.1%、0.5%、1.0%、2.0%、4.0%、6.0%、8.0%、10.0%和12.0%。
1.5不同浓度阳离子对聚磷菌G2合成废水除磷效率的影响
以酵母粉和乙酸钠为碳源模拟水体中的BOD含量,并利用氯化铵模拟水体环境中的氨氮。分别调节人工合成废水中Ca2+、K+、Mg2+3种阳离子的浓度,并考察其对菌株G2除磷效果的影响。
2结果和讨论
2.1新型高效聚磷菌的筛选鉴定
2.1.1新型高效聚磷菌的分离筛选
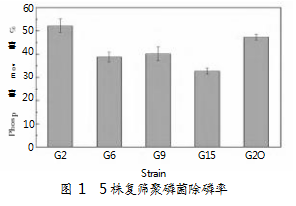
通过富集驯化、分离纯化、MOPS初筛及异染颗粒染色复筛等,从污泥样品中分离得到32株具有黑色颗粒的聚磷菌。分别对其进行聚磷性能的定量测试,发现其中5株菌的磷去除率>30%,将其依次编号为G2、G6、G9、G15、G20,具体如图1所示。其中,又以菌株G2的除磷能力最强,其除磷率高达52.18%,显著高于其他菌株。因此,本试验选取G2开展后续研究。
2.1.2新型聚磷菌G2菌种鉴定
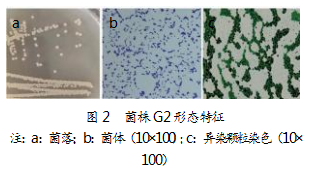
如图2-a所示,菌株G2在LB固体培养基上的菌落形态呈圆形,表面光滑湿润、呈淡黄色;形态为短杆状,大小约为(2.12±0.23)μm×(0.71±0.04)μm(见图2-b),属于革兰氏阳性菌,不产芽孢;菌体内包含明显的蓝黑色异染颗粒(图2-c)。菌株G2可水解淀粉和吐温,不能水解纤维素、蛋白质等大分子化合物;吲哚、产H2S试验阳性,VP、MR、明胶液化试验为阴性。同时,能利用L-阿拉伯糖、纤维二糖、D-果糖、D-葡萄糖、麦芽糖等作为生长碳源,并将L-精氨酸、L-甘氨酸、L-组氨酸等作为氮源。此外,该菌株的耐受盐浓度高达12%,为其在高盐浓度废水中的应用提供了条件。具体形态特征如图2所示。
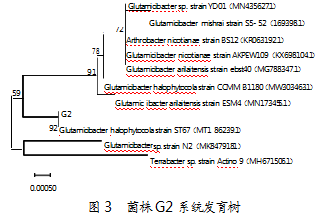
测序得到菌株G2的16S rRNA基因序列大小为1 527 bp。将该序列在NCBI中进行BLAST序列比对后发现,其与盐生谷氨酸杆菌(Glutamicibacter halophytocola)strain ST67的亲缘关系最近,相似性高达92.0%。利用MEGA 7.0软件构建的系统发育树如图3所示。此外,ANI分析表明,G2与Glutamicibacter halophytocola strain DR408的ANI值为98.37%。综上所述,结合形态特征观察与生理生化反应结果可以得出,菌株G2为盐生谷氨酸杆菌(Glutamicibacter halophytocola)。当前关于盐生谷氨酸杆菌在植物促生、抗病及抗氧化活性等方面的研究较多,少见有关其在污水除磷性能方面的报道。
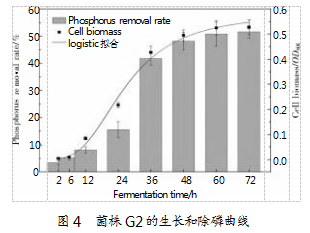
2.2聚磷菌G2的生长曲线和除磷曲
菌株G2在28°C、180 r/min培养条件下测得的生长曲线如图4所示。由图可知,菌株G2的生长适应期稍长,约为6 h;6~12 h为对数增长前期,表明菌株G2已充分适应环境,增长速率提高,OD600值保持在0.3~0.8;培养12 h后菌体浓度呈指数增长,说明菌体开始进入对数生长期了,并一直持续到第60 h,此时菌液的OD600达到最大值0.885。随后,菌株生长进入稳定期,菌体总量保持稳定,OD600数值变化较小;培养72 h后进入生长衰亡期,OD600值开始降低。将菌株在聚磷培养基中的生长变化情况进行逻辑斯蒂方程拟合,模型拟合系数为R2=0.999 2,拟合效果良好,说明盐生谷氨酸杆菌在聚磷培养基上的生长过程符合逻辑斯蒂生长规律。菌株G2磷去除率的变化趋势与活菌增长规律保持一致,也呈“S型”变化。处于迟缓期时,磷酸盐去除率较低;进入对数生长期时,磷去除率从5.17%增长至48.13%;进入稳定期后,磷去除率基本保持在50.76%左右。
2.3环境因素对高效聚磷菌G2除磷性能的影响
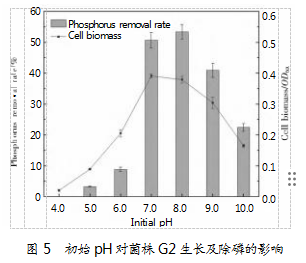
2.3.1初始pH对菌株G2生长及除磷的影响
初始pH对菌株G2生长及除磷性能的影响如图5所示。由图可知,随着pH逐渐增大,G2的除磷率呈现出了先升高后降低的发展趋势,在pH为8.0时除磷效果最佳,除磷率达53.45%。当pH≥9.0时,G2的除磷率开始降低,磷去除率仅为40.94%。研究表明,pH越大越容易形成磷沉淀,除磷效率也会随之降低。而pH≤6.0时G2几乎无法生长,除磷效果非常差,仅为8.86%。这一现象表明,该pH下菌株基本没有聚磷能力,磷下降仅为细胞生长和正常代谢所需。以上结果表明,菌株G2更适合在中性或弱碱性环境中生长,pH过高或过低都会影响其除磷效率。据报道,在生物除磷系统中,PAOs对pH要求非常严格,过酸环境会影响细胞酶活性和细胞膜电荷,进而抑制PAOs的生长及除磷过程[20]。类似研究表明,低pH会抑制生物量增长、林德吸收,以及PHA利用,而中性偏碱的pH更利于实现PAOs的除磷效能。因此,pH为7.0~8.0的中性或弱碱性环境更适宜聚磷菌生长及其聚磷过程。
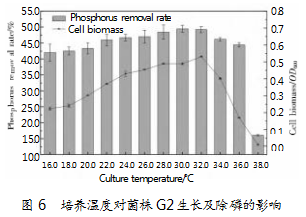
2.3.2培养温度对菌株G2生长及除磷的影响
培养温度对菌株G2生长及除磷效果的影响如图6所示,由图可知,不同温度条件下培养菌株的生长量和除磷率呈正相关,随着温度逐渐升高,二者均表现出先上升后下降的发展趋势。在16℃初始升温阶段,菌株除磷率为42.02%,随着温度升高,除磷率也在逐渐提高,32°C时生物量和除磷率(49.45%)均达到最大值(P<0.05)。继续提高温度时,菌株除磷率开始降低,38℃时降为16.13%。究其原因可能是温度过高导致菌株在聚磷过程中相关酶的活性有所降低,且菌株生长情况及除磷率也受到了一定的影响。现有研究表明,低温有利于活性污泥系统中传统PAOs的生长,PAOs在低温条件下更具竞争优势。刘有华等[13]的研究表明,影响聚磷菌P6-1除磷效率的主要因素,按照其作用强度依次排列为温度>pH>装液量。张深[21]认为,低温条件下聚磷菌的生长速度很慢,但温度对生物除磷效果影响很小。该结论与本文试验结果恰好一致。
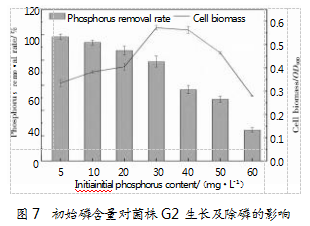
2.3.3初始磷含量对菌株G2生长与除磷的影响
磷作为菌体生长发育必不可缺的元素之一,浓度过高或不足都会影响微生物的新陈代谢。图7展示了初始磷含量对菌株G2生长与除磷效率的影响,发现实验条件下聚磷菌的除磷率会随着磷浓度升高而不断降低。当初始磷质量浓度在5~30 mg/L时,菌株生长量随着初始磷含量的升高而显著增加,并在30 mg/L时达到最大值(P<0.05)。而随着初始磷含量的继续升高,菌株生长会受到抑制,除磷率反而会下降。当磷质量浓度为60 mg/L时,除磷率降至26.73%。整体来看,在初始磷质量浓度为30 mg/L时,菌株生长及除磷效果最佳,磷去除率为78.79%,磷减少量达23.64 mg/L,显著高于初始磷浓度为50 mg/L时的21.48 mg/L。
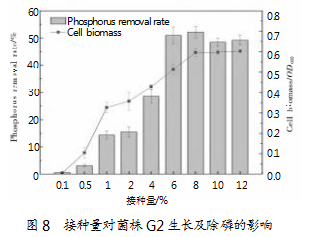
2.3.4接种量对菌株生长G2及除磷的影响
选择不同的接种量接种到聚磷培养基中,得到的除磷效果也各不相同。图8展示了接种量对菌株生长G2及除磷效果的影响,由图可知,在相同条件下培养相同时间后,培养基中盐生谷氨酸杆菌G2的菌体浓度会随接种量增大而提高,最适接种量为8%。当接种量为0.5%~12%时,上清液中的磷去除率随接种量增大而提高。当接种量超过4%后,磷去除率显著提高;当接种量达到8%时,磷去除率最高,为52.20%;然后继续增大接种量对盐生谷氨酸杆菌G2的除磷效果无显著影响。总体而言,适当的接种量可以缩短菌体达到最大浓度的时间,对于提高除磷效率具有显著影响,因此,菌株G2的最适接种量为8%。若接种量过低,则菌体增殖缓慢,除磷效果不佳;若接种量过高,生物量就会呈指数式增长,营养物质消耗殆尽,菌体受到生长与繁殖的压力,同样会除磷效率低下。
2.4不同阳离子对聚磷菌G2在人工合成废水中除磷的影响
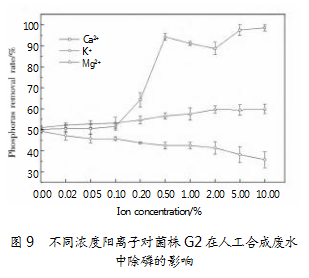
现有研究指出,金属离子(特别是镁离子)是生物除磷工艺启动并稳定运行的关键因素。微生物在代谢过程中会发生各种类型的酶促反应,钙、镁和钾离子是众多酶的激活剂组成成分,会直接或间接影响微生物的代谢活动。图9展示了聚磷菌G2在人工合成废水中除磷率随Ca2+、Mg2+、K+3种不同阳离子浓度变化的除磷趋势。数据显示,添加适当浓度的Mg2+可显著提高磷去除率,在添加量为2.0%时达到最大值59.95%,比未添加Mg2+时的51.02%可以提高17.50%。已有研究表明,镁离子可作为酶促剂参与到聚磷酸盐的合成和分解过程中,镁离子浓度越大,其相应的磷酸盐去除率也会越高。Schönborn等[22]认为,镁离子参与磷酸盐在胞内的运输过程,并可以维持胞内聚磷酸盐的稳定性。李幸等[23]的研究结果表明,在生物除磷系统的启动阶段,充足的镁离子可以促进聚磷菌的快速富集,且Mg/P值在0.2~0.6时系统的磷酸盐去除效果最佳。Ca2+添加量为0~0.1%时,磷去除率变化不大。当添加量达到0.2%时,磷去除率急剧提高,在0.5%时达到最高值94.30%。这是因为较高浓度的Ca2+会与磷酸根发生反应进而产生沉淀。王晓霞等[24]的研究结果显示,钙离子与生物除磷过程中的化学沉淀反应息息相关。Schönborn[22]则认为,30~80 mg/L的Ca2+浓度对系统的整体除磷性能无显著影响。该结果与本研究结果类似。在本实验中,K+对菌株G2的除磷率具有一定的抑制作用,与任皓甜[25]研究所得的结论不同。究其原因可能是除磷菌株种属不同,代谢途径也有所差异,具体机制还需进一步进行试验验证。试验数据如图9所示。
3结论
本文通过富集驯化、分离纯化,结合MOPS蓝白斑(10×)初筛、Albert异染颗粒复筛等方法获得了23株聚磷菌,通过对其聚磷性能的定量测定,发现初始P质量浓度为50 mg/L时有5株菌株的除磷率高于30%。其中,菌株G2的除磷能力最强,除磷率可达52.18%。
通过形态学、生理生化和16S rRNA序列比对,以及平均核苷酸分析(ANI)等方法,初步鉴定菌株G2为盐生谷氨酸杆菌(Glutamicibacter halophytocola)。
菌株G2在初始磷质量浓度为30 mg/L、pH为8.0、接种量8%、温度32℃条件下发酵72 h后,磷去除率可达78.79%。并且研究发现,Mg2+对菌株G2在人工合成废水中的除磷效果影响最大,Mg2+添加量为2.0%时可将磷去除率提高17.50%。
参考文献
[1]MENGYANG L,HANMIN Z,YU T.The collaborative incentive effect in adsorption-photocatalysis:A special perspective on phosphorus recovery and reuse[J].Water research,2023,242:120237.
[2]QIAN Z,YURU W,JIAYANG H,et al.Comparison study on enhancement of phosphorus recovery from low-strength wastewater treated with different magnesium-based electrochemical constructed wetland[J].Journal of Environmental Management,2023,345:118840.
[3]辛浩洋,张华,黄健,等.磺胺甲恶唑对除磷微生物胞内聚合物的影响研究[J].水处理技术,2023,49(10):113-117.
[4]LIGUI W,QIAOFENG W,JINGCHENG X,et al.Responses of antibiotic resistance genes in the enhanced biological phosphorus removal system under various antibiotics:Mechanisms and implications[J].The Science of the Total Environment,2023,905:167247.
[5]RELLEGADLA S,FRANCO J M,VIEIRA W M,et al.Effect of biofilm thickness on the activity and community composition of phosphorus accumulating bacteria in a moving bed biofilm reactor[J].Water Research,2023,245:120599.
[6]岳宜菲.高效聚磷菌的筛选及其在废水除磷中的应用研究[D].郑州:河南工业大学,2021.
[7]Liping C,Gengrui W,Yushen Z,et al.Candidatus Accumulibacter use fermentation products for enhanced biological phosphorus removal[J].Water Research,2023,246:120713.
[8]安健,伏光辉,阮记明,等.反硝化除磷菌筛选及其特性研究[J].微生物学通报,2012,39(2):162-171.
[9]蔡倩,喻乐意,汪健健,等.高效聚磷菌株的筛选与鉴定[J].贵州农业科学,2014,(12):149-151,156.
[10]吴晓青,吕玉平,周方园,等.设施农业土壤中聚磷菌的筛选及其生物学特性分析[J].农业环境科学学报,2019,38(8):1704-1711.
[11]张华,马涛,李丽,等.生物除磷工艺中高效聚磷菌的快速筛选和鉴定[J].安徽建筑大学学报,2020,28(1):69-72.
[12]谢蔚鹏,褚文珂,陈敏.反硝化聚磷菌的筛选及多样性分析[J].杭州师范大学学报(自然科学版),2018,17(6):597-601.
[13]刘有华,魏慧,王倩楠,等.一株高效聚磷解淀粉芽孢杆菌的分离鉴定及其除磷条件优化[J].微生物学通报,2021,48(5):1473-1485.
[14]相延铮,何成达,朱腾义,等.碳源对除磷颗粒污泥去除效果和微生物特性的影响[J].工业水处理,2023,(10):1-12.
[15]王雨.高效聚磷菌不动杆菌属的磷转化途径及基因组分析[D].西安:西安建筑科技大学,2022.
[16]祁欣,王建辉,刘俞辰,等.聚磷菌的筛选鉴定及其影响因素试验研究[J].长春工程学院学报(自然科学版),2023,24(1):113-118.
[17]刘俞辰.EBPR工艺中聚磷菌的筛选鉴定及其影响因素研究[D].长春:吉林建筑大学,2022.
[18]东秀珠,蔡妙英.常见细菌系统鉴定手册第8版[M].北京:科学出版社,2001.
[19]布坎南RE.伯杰氏细菌鉴定手册第8版[M].中国科学院微生物研究所,译.北京:科学出版社,1984.
[20]胡孟飞.高效除磷酵母菌株Candida rugosa BL3的除磷效能及除磷机理研究[D].济南:济南大学,2020.
[22]SCHÖNBORN C,BAUER H.D,R?SKEI.Stability of Enhanced Biological Phosphorus Removal and Composition of Polyphosphate Granules[J].Water Research,2001,35:3190-3196.
[23]李幸,高大文,刘琳.镁离子浓度对SBR生物除磷系统的影响[J].环境科学,2011,32(7):2036-2040.
[24]王晓霞,吕树光.磷酸钙盐法回收剩余污泥超声波处理上清液中磷的研究[J].安全与环境学报,2012,12(2):16-19.
[25]任皓甜.环境因素对聚磷菌释磷和摄磷的影响及超量聚磷机理研究[D].西安:西安建筑科技大学,2018.
文章出自SCI论文网转载请注明出处:https://www.lunwensci.com/ligonglunwen/79038.html