摘要:文章研究盐胁迫对小球藻胞外多糖积累及抗氧化性的影响,并分析了其他生理指标。结果表明,在无胁迫条件下,小球藻胞外多糖的含量为0.065 3 mg/mL,过氧化氢清除率为11.96%,DPPH自由基清除率为0.98%;在盐胁迫质量浓度为6 g/L时,小球藻胞外多糖的含量达到0.114 3 mg/mL,过氧化氢清除率为44.57%,DPPH自由基清除率为3.25%,同时叶绿素含量8.7 mg/L,蛋白质含量162.62μg/mL,丙二醛含量165.83μmol/mL,为实验组中最高。这说明适宜浓度的盐胁迫会提高小球藻胞外多糖的积累及其他有效产物的合成。
关键词:盐胁迫,小球藻,胞外多糖,抗氧化性
近年来,随着工业发展、环境恶化、人口增长[1],导致粮食资源短缺问题加剧。与此同时,微藻因其多营养性质符合大食物观全方位、多途径开发食物资源的要求[2],而在功能食品开发方面备受青睐。微藻不仅含有多种易被人体消化的营养元素,还具有抗氧化、免疫调节、抗肿瘤、增强免疫性等多种功能活性[1]。微藻多糖作为一种重要的生物活性物质,具有广阔的应用前景。
小球藻(Chlorella)是一种单细胞绿藻,光合能力强、繁殖快、分布范围广,含有丰富的多不饱和脂肪酸、蛋白质、多糖、维生素和矿物质等营养物质,被广泛应用于食品领域[3]。蛋白核小球藻已于2012年被国家批准为新资源食品,并在美国和欧盟也获得了批准[4]。然而,在中国,由于育种、养殖、加工方式、活性物质提取纯化,以及食品开发与接受程度的限制,小球藻食品相关产业并没有实现规模化。
鉴于藻类在受胁迫影响下会改变细胞结构、细胞膜渗透压,以及胞外分泌物量[5],为解决小球藻胞内多糖提取困难及利用率低的问题,本文以BG-11为基本培养基,并添加一定浓度NaCl模拟盐胁迫条件,以探索外界盐胁迫对小球藻生物量和胞外多糖含量的影响。同时,本文将测量小球藻胞外多糖的抗氧化性及其他生理指标,以期为培育高产多糖及蛋白质的小球藻提供理论基础,助力开发小球藻功能性食品或生物活性制剂。
1材料与方法
1.1材料与试剂
小球藻为市售的普通蛋白核小球藻;BG-11培养基;硫代硫酸钠标准滴定液(0.05 mol/L);DPPH(二苯基-2-三硝基苯肼)(96%)。
1.2试验方法
1.2.1小球藻培养与盐胁迫处理
取小球藻藻种,加入到100 mL,经过灭菌处理的BG-11培养基中。在光照强度2 800 Lux,温度24℃,转速为142 r/min的条件下,进行为期24 h的光照复苏培养。取6只250 mL三角瓶,每瓶加入100 mL经过灭菌处理的BG-11培养基,并在培养基中加入不同浓度的NaCl,使得最终盐质量浓度分别为0 g/L,3 g/L,6 g/L,9 g/L,12 g/L,15 g/L。接种经过复苏培养进入对数生长期的小球藻藻种,然后在上述条件下继续培养。
1.2.2盐胁迫条件下小球藻生长状态检测
对小球藻光照培养期间进行定期采样和计数,并用血细胞计数板绘制生长曲线。计数时采用规格血球计数板,以计算五大格中的小球藻数。
1.2.3小球藻胞外多糖的提取纯化与含量测定
培养5 d的小球藻悬液重复抽滤去除小球藻藻体及杂质,分别取10 mL上清液加入30 mL 95%乙醇并充分混匀,直至液体中产生白色絮状沉淀后,放入冰箱4℃静置过夜。将沉淀取出倒掉上清液,并放入离心机中以4 000 r/min的速度离心15 min。沉淀用无水乙醇洗涤2次,即得到粗多糖。将粗多糖溶于10 mL水中,然后按照提取液体积的三分之一加入Sevag试剂,混匀后放入摇床以180 r/m的速度振荡30 min。将混合溶液以3 000 r/min的转速离心15 min。重复上述操作,直至所得样品溶液的氯仿层与正丁醇层之间无乳白色变性蛋白质析出为止[6]。提取的胞外多糖采用苯酚-硫酸法测定其含量。
1.2.4小球藻胞外多糖抗氧化活性的测定
过氧化氢清除能力检测
取1 mL胁迫溶液样品与1 mL 0.1 mmol/L的H2O2混合,摇匀后加入100μL3%的钼酸铵,混匀后继续添加10 mL 2 mol/L的H2SO4和7.0 mL 1.8 mol/L的KI,摇匀后置于避光条件下反应15 min,最后用5 mmol/L硫代硫酸钠标准溶液滴定并计算过氧化氢清除率。
DPPH自由基清除能力检测
配制质量浓度为40μg/mL DPPH溶液(冰箱中避光保存),取2 mL各盐浓度下溶液样品,加入2 mL上述DPPH溶液,摇匀后在黑暗条件下放置30 min,于517 nm下测定吸光度并计算DPPH清除率。
1.2.5最适盐胁迫浓度下小球藻生化指标测定
蛋白质含量的测定
采用考马斯亮蓝法取盐胁迫下小球藻原液10 mL于15 mL离心管中,3 000 r/min,离心10 min,弃去上清液,用2 mL PBS重悬细胞。再将细胞悬液至于5 mL烧杯中用细胞破碎仪破碎,将细胞悬液收集于10 mL比色管中,于37℃水浴保温30 min后转移到离心管中,12 000 r/min离心10 min后收集上清,即为粗酶液。取1 mL粗酶液处理后测其吸光值,即可根据标准曲线得到样品中的蛋白质含量。
叶绿素含量的测定
叶绿素包括叶绿素a、叶绿素b、类胡萝卜素等,在混合溶液中各组分吸光率是可以相加的。因此,只需要测三个特定波长下的吸光度值,即可得到样品色素的总含量。在95%的乙醇中,叶绿素a、叶绿素b、和类胡萝卜素提取液在红光区的最大吸收波长分别为665 nm、649 nm及470 nm。在排除类胡萝卜素的影响后,计算叶绿素含量。
丙二醛含量的测定
在酸性条件下,且温度较高时,丙二醛会与2-硫代巴比妥酸(TBA)反应生成红棕色物质。通过该物质在532 nm处的吸光度,可以计算溶液中丙二醛的含量。取3 ml粗酶液与5 mL 0.5%的TBA溶液反应后,在450 nm、532 nm和600 nm波长下测量吸光度,并计算MDA含量。具体公式如下。
C(MDA)=6.45(A 532-A 600)-0.56A 450
式中:C(MDA)为MDA浓度,单位为μmol·L-1,以材料的鲜重(μmol/g)表示MDA的含量。
1.3数据处理
所有测试指标均重复三次,采用SPSS 20.0软件统计分析,且组间采用单因素方差分析,P<0.05为显著。
2结果与分析
2.1盐胁迫对小球藻生物量的影响
研究发现,在培养48~168 h期间,小球藻的繁殖速度一般较高。在3 g/L和6 g/L盐浓度胁迫下,小球藻的繁殖速度高于对照组。然而,随着盐浓度的增加,小球藻的细胞数目下降,说明低浓度盐胁迫有利于小球藻的快速生长,可增加其密度。随着培养时间延长至168 h,各浓度盐胁迫条件下小球藻的生长速度呈现下降趋势,尤其在3 g/L和6 g/L盐浓度条件下降最为显著,且藻体也出现大量死亡。其他各处理的生长情况变化不明显,但对照组的小球藻一直呈现增长趋势。在培养144 h后,盐胁迫质量浓度为6 g/L组的小球藻细胞数目最多,远高于对照组。这表明6 g/L的盐质量浓度更适宜小球藻生长。使用血球计数板计算小球藻细胞数如图1所示。
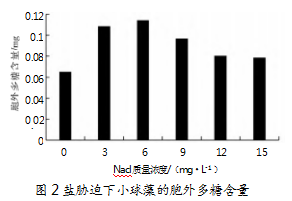
2.2盐胁迫对小球藻胞外多糖含量的影响
研究发现,胞外多糖含量随盐浓度的升高先上升后下降,并在盐浓度为6 g/L时达到最高,为0.114 3 mg/mL。随着盐质量浓度升高,胞外多糖的含量逐渐降低,与小球藻细胞数量表现出一致性,但在盐胁迫条件下,小球藻胞外多糖的含量比对照组高,说明盐胁迫会导致微藻细胞发生渗透压改变,使小球藻胞外多糖的合成释放量增加。不同藻类对盐度的接受能力有一定区别,由于试验中采用的小球藻为淡水小球藻,受盐度的影响较大,故确定盐质量浓度为6 g/L为最佳胁迫浓度。具体数据如图2所示。
2.3 盐胁迫下小球藻胞外多糖抗氧化能力测定
2.3.1 盐胁迫下小球藻胞外多糖清除过氧化氢能力
在盐质量浓度为6g/L时,小球藻胞外多糖对过氧化氢清除率达到44.57%,是无胁迫培养下3.73倍。根据胞外多糖含量可知,盐质量浓度为6g/L时,小球藻胞外多糖含量最高。由于小球藻胞外多糖具有抗氧化性,在相同胁迫条件下,小球藻胞外多糖的过氧化氢清除率也相对较高。盐胁迫下过氧化氢的清除率具体如图3所示。
2.3.2 盐胁迫下小球藻胞外多糖清除 DPPH 自由基能力
研究显示,小球藻胞外多糖对DPPH自由基的清除率在 Nacl 质量浓度为6g/L时,达到最高值3.25%,是无胁迫培养的3.32倍,这是因为小球藻胞外多糖中存在的还原性末端可以直接作用于自由基,具有清除DPPH自由基的能力。因此,在6 g/L盐质量浓度胁迫时,小球藻胞外多糖含量达到最大值,DPPH 自由基清除率也达到最大值。
2.4盐胁迫对小球藻生化指标的影响
微藻蛋白更优于小麦等谷物蛋白,且其必需氨基酸含量与人体需要更接近。因此,小球藻中蛋白质的含量也是其作为功能性食品原料开发的指标之一。另外,叶绿素、类胡萝卜素作为小球藻中的重要生物活性物质在调节生理功能、抗氧化、抗肿瘤等方面具有重要作用5,是提升小球藻在食品加工中品质的重要指标。因此,在最适盐胁迫培养的条件下,测定小球藻蛋白质、叶绿素a、叶绿素b、类胡萝卜素含量具有重要意义。同时,为确定小球藻在盐胁迫条件下细胞膜的受损程度及抗逆性,实验还测定了小球藻细胞中丙二醛(MDA)的含量。各理化指标检测结果如表1所示。
研究结果显示,在盐质量浓度为6 g/L胁迫条件下,小球藻蛋白质含量比在正常培养条件下较高。这可能是因为在盐胁迫条件下,金属离子如 Nat会通过诱导相关蛋白的表达参与细胞代谢,从而降低外界胁迫对植物的毒性作用。另外,适度盐胁迫条件下小球藻叶绿素总量及叶绿素a、叶绿素b、类胡萝卜素含量都有提高,推断出盐胁迫可使胞内离子含量提高,进而导致叶绿素与叶绿素蛋白结合受到抑制而解离出来。在盐胁迫条件下,小球藻细胞中的MDA含量比对照组0 g/L NaCl高,说明小球藻细胞膜此时受损程度较大;同时,该条件下其抗逆性也最强,可见小球藻在遭受外界盐胁迫时,会调节自身内环境以适应外界环境变化。
3结论
本文通过试验,初步探究了盐浓度胁迫对淡水小球藻胞外多糖产量及抗氧化能力的影响。由试验结果可知,一定浓度的盐胁迫有利于小球藻释放胞外多糖,且提高多糖含量的最佳盐胁迫质量浓度为6 g/L,可使小球藻胞外多糖的产量达到0.1143 mg/mL,是无胁迫培养小球藻胞外多糖产量的1.75倍;同时,试验还探究了盐胁迫下胞外多糖的抗氧化能力。结果显示,胞外多糖的抗氧化性与胞外多糖的产量存在一定的正相关性。
不同浓度盐胁迫对小球藻的部分生理状态具有不同影响。低浓度盐可以促进小球藻生长,其生长曲线呈负相关。盐胁迫质量浓度为6 g/L时,小球藻细胞生物量、蛋白质和叶绿素含量也更高;同时,该条件下的小球藻细胞MDA含量也是最高的,即膜的受损程度最大,抗逆性也最强。小球藻含有丰富的优质蛋白、多种维生素、叶绿素、叶酸等,保健效果显著,在盐胁迫下可以促进部分产物的合成。因此,可以利用废水或者海水培养小球藻,在保护环境的同时,降低生产成本,为实现小球藻功能化食品生产奠定基础。
参考文献
[1]刘美彤,齐悦,何勇锦,等.微藻及其在未来食品中的应用[J].福建师范大学学报(自然科学版),2023,39(3):53-62.
[2]廖小军,赵婧,饶雷,等.未来食品:热点领域分析与展望[J].食品科学技术学报,2022,40(2):1-14,44.
[3]郑潇,周化岚,Gultom Sarman Oktovianus,等.黑曲霉快速高效收获异养小球藻的条件优化[J].食品与发酵工业,2021,47(23):16-23.
[4]郝俊光,潘喜芳,莫维,等.小球藻作为食品利用的国外报道研究进展[J].中国酿造,2022,41(10):18-24.
[5]史瑞琴,梁静静,李大伟,等.小球藻多糖的分离纯化及理化性质[J].食品科学,2020,41(20):61-67.
[6]罗春萍,陆友利,王星星.苯酚-硫酸法快速测定多糖方法的优化[J].化工管理,2021(03):90-91,94.
文章出自SCI论文网转载请注明出处:https://www.lunwensci.com/ligonglunwen/79036.html