SCI论文(www.lunwensci.com):
摘要:目的:建立紫外-可见分光光度法测定灵芝菌丝中多糖含量的方法。方法:以无水葡萄糖为对照品,苯酚和硫酸为显色剂,在485nm波长处测定灵芝菌丝体中多糖含量。结果:灵芝菌丝中多糖含量0~0.115 20 mg范围内线性关系良好(R2=0.999 2),精密度RSD为1.42%。样品溶液在配制后12 h内稳定性较好,平均加标回收率为100.61%,RSD为0.97%。结论:该方法方便快捷,重现性好,结果可靠,适用于测定灵芝菌丝体中多糖含量。
关键词:灵芝菌丝;多糖含量;苯酚-硫酸法
灵芝(ganodermalucidum)也叫瑞草、仙草等,为名贵的药用真菌[1]。现代医学表明,其具有调节免疫力、抗肿瘤、抗衰老、保肝、提高机体耐缺氧能力等活性[2-6]。灵芝子实体和菌丝体中均含多糖类、三萜类、甾醇类、生物碱等多种化学活性成分,其中多糖类是其主要有效成分之一,也是大多数灵芝类产品的质量控制的指标成分[7]。
目前,市面上有很多灵芝菌丝类产品,宣传的保健功能与灵芝类似,但主要活性成分多糖的检测方法尚没有统一的国家标准,主要采用的有苯酚-硫酸法和蒽酮-硫酸法[7-12]。但杨瑞瑞[8]报道采用蒽酮-硫酸法测定灵芝中多糖含量时易形成浑浊,无法显色测定,故本次选用苯酚-硫酸法来进行研究。本研究较系统地建立了灵芝菌丝体中多糖的含量检测方法,以期为灵芝菌丝类产品质量标准制定及产品深度开发提供参考。
1材料与仪器
1.1材料与试剂
灵芝菌丝粉,由山西瑞芝生物科技有限公司培养灵芝菌丝体,再干燥粉碎后制备。
D-无水葡萄糖,批号:110833-201506,中国食品药品检定研究院。
主要试剂:苯酚,批号160806,四川西陇科学股份有限公司;无水乙醇,批号181218,四川西陇科学有限公司;95%乙醇,批号180619,四川西陇科学有限公司;浓硫酸,批号180514,四川西陇科学有限公司;二水合磷酸二氢钠,批号160307,四川西陇科学有限公司;无水磷酸氢二钠,批号160812,四川西陇科学有限公司;糖化酶,批号105A011,北京索莱宝科技有限公司;碘化钾,批号20171205,天津市风船化学试剂科技有限公司;碘,批号2017101701,成都市科龙化工试剂厂。以上均为分析纯;水为双蒸水。
1.2主要仪器
UV-1100紫外/可见分光光度计,上海美谱达仪器有限公司;2BP211D电子天平,德国赛多利斯公司;HH-S4数显恒温水浴锅,常州市国旺仪器制造有限公司;centrifuge 5804R离心机,德国艾本德股份公司;GL-88B旋涡混合器,海门市其林贝尔仪器制造有限公司。
2方法与结果
2.1溶液的制备
苯酚-硫酸分光光度测定法常用于灵芝类产品中多糖含量测定,本研究选用此法,系统地对其在灵芝菌丝粉中多糖含量测定适用性进行研究[13-15]。
1)5%苯酚溶液:精密称取5.063 50 g苯酚,加水溶解并定容至100 mL,混匀,临用新配。
2)0.2 mol/L磷酸盐缓冲液(pH=6.5):31.5 mL 0.2 mol/L磷酸氢二钠(称取2.839 21 g无水磷酸氢二钠加水至100 mL溶解)与68.5 mL 0.2 mol/L磷酸二氢钠溶液(称取3.120 20 g二水合磷酸二氢钠加水至100 mL使溶解)混合。
3)碘液:称取130 048 g碘及3.500 71 g碘化钾,溶于10 mL水中,稀释定容至100 mL,摇匀,贮存于棕色瓶中。
4)葡萄糖标准溶液:精密称取D-无水葡萄糖标准品0.011 53 g,加水溶解并定容至100 mL,即得含0.115 2 mg/mL葡萄糖标准溶液。
5)80%(体积分数)乙醇溶液:量取421 mL 95%乙醇,加入79 mL纯净水,即得。
6)供试品溶液:按适用性考察内容及方法,精密称取混合均匀的样品约2 g,置于100 mL容量瓶中,加水80 mL,于沸水浴中加热1h,取出冷却至室温,补加水至刻度(V1),即为样品提取液。
取50 mL(V2)样品提取液,置于100 mL(V3)容量瓶中,冷却至60℃以下,加0.5 mL 0.2 mol/L磷酸盐缓冲液,加塞,置55~60℃下1 h,再加0.5 g糖化酶(约为样品体积的1%)于60℃以下再水解60 min后取出(用碘液检查是否水解完全,如不完全可延长水解时间至酶解液加碘液不变蓝色为止),于电炉上加热至沸(灭酶),冷却,定容,过滤,取滤液沉淀多糖。
精密吸取滤液5 mL(V4),置于50 mL离心管中,加入无水乙醇20 mL,混匀,4℃冰箱静置过夜(约14 h),以4 000 r/min离心5 min,弃去上清液,残渣用80%(体积分数)乙醇溶液洗涤,离心后弃去上清液,反复操作3次。残渣用水溶解并定容至25 mL(V5),即得。
7)空白制剂溶液:按适用性考察内容及方法,精密称取混合均匀的空白制剂,按6)项下供试品溶液制备同法制备,即得。
2.2样品测定
根据适用性考察内容及方法要求,精密吸取供试品溶液1.0 mL(V6),置于25 mL比色管中,补加水至2.0 mL,加入5%苯酚溶液1.0 mL,在旋涡混合器上混匀,加入浓硫酸10 mL,在旋涡混合器上混匀,置沸水浴中2 min,冷却至室温。用分光光度计在485 nm波长处以试剂空白作参比,1 cm比色皿测定吸光度值。
多糖含量计算公式[式(1)]:
式中:X为样品中粗多糖含量,g/100g;m1为样品测定液中葡萄糖的质量,mg(可通过测定样品吸光度代入线性方程计算而得;m2为样品取样量,g;V1为样品提取液总体积,mL;V2为样品用于水解提取液体积,mL;V3为样品水解后定容体积,mL;V4为沉淀粗多糖所用样品提取液体积,mL;V5为沉淀粗多糖定容体积,mL;V6为测定用样品液体积,mL;1 000为mg与g单位换算;0.9为葡萄糖换算为粗多糖的系数。
2.3测定波长选择
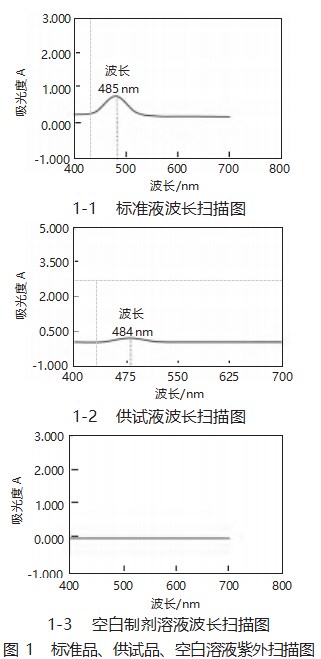
精密量取葡萄糖标准品溶液和6)项下的供试品溶液和7)项下空白制剂溶液各1mL,按8)项下样品测定处理并于紫外分光光度计400~700 nm波长范围进行紫外扫描,记录紫外扫描图,详见图1。
从图1可以看出,供试品与葡萄糖标准品在485 nm±2 nm处均有最大特征吸收峰,而空白制剂溶液在485 nm波长处没有吸收。表明本品选择485 nm作为测定波长具有专属性,空白制剂溶液对检测结果没有干扰。
2.4方法学考察
2.4.1线性关系
精密吸取葡萄糖标准溶液(0.1152 mg/mL)0.00、0.10、0.20、0.40、0.60、0.80、1.00 mL(相当于葡萄糖0.000 00、0.011 52、0.023 04、0.046 08、069 12、0.092 16、0.115 20 mg)分别置15 mL具塞试管中,按照5)样品测定处理并测定吸光度,结果见表1。
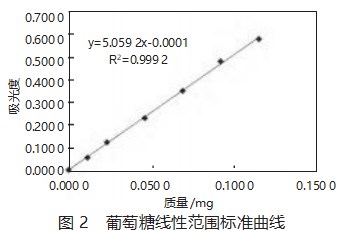
以葡萄糖质量为横坐标,吸光度值为纵坐标绘制标准曲线,见图2。
从图2可以得到,线性方程为y=500 592x-0.000 1,R2=0.999 2。表明多糖质量在0.00~0.115 20 mg范围内线性关系良好。
2.4.2精密度实验
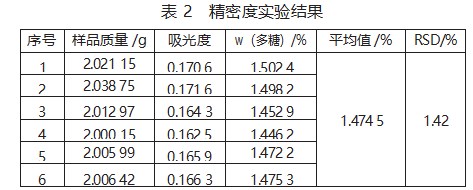
平行称取6份供试品,按上述方法测定并计算多糖含量,结果见表2。
从表2可以看出,6份供试品的多糖平均质量分数为1.474 5%,RSD为1.42%<2%,表明此方法精密度良好。
2.4.3稳定性考察
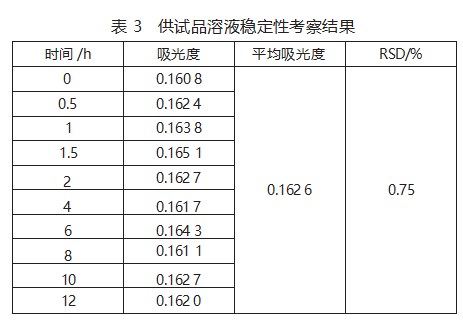
精密称取本品1.968 73 g,按6)项制备供试品溶液,后按8)项样品测定方法处理得到显色溶液,室温下放置,分别于显色完成后的0、0.5、1、1.5、2、4、6、8、10、12 h各测定一次吸光度值,结果见表3。
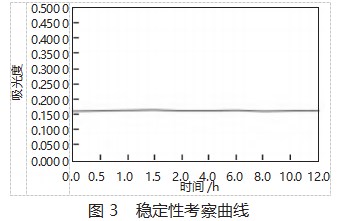
以测定时间为横坐标,吸光度值为纵坐标,绘制稳定性考察曲线图,见图3。
结合表3和图3可以看出,供试品溶液显色后的吸光度值在12 h内基本稳定,RSD为0.75%<2%,此方法稳定性符合规定。
2.4.4准确度考察
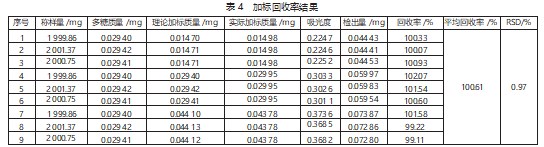
分别精密称取已知多糖质量分数为1.47%的本品3组,每组约2 g,按6)项下方法制备供试品溶液。每组3管,共9管,分别精密量取供试品溶液1 mL,置于25 mL比色管中。第一组、第二组、第三组各比色管按供试品溶液所含多糖质量的约50%、100%、150%分别添加葡萄糖标准溶液(即分别添加质量浓度为0.115 2 mg/mL的葡萄糖标准液0.13、0.26、038 mL)。标准品与样品混合后按8)项下样品测定处理并测定吸光度,计算加标回收率,结果见表4。
加标回收计算公式:
从表4可以看出,葡萄糖的平均加标回收率为100.61%,RSD为0.97%<2%,加标回收率符合规定,表明此方法准确度良好。
3样品含量测定
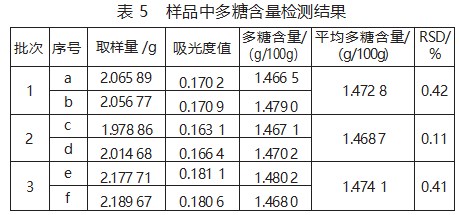
取3批产品试样,每批产品平行取两份样品。精密称取样品约2 g,按6)项下方法平行制备共6份供试品溶液,按照8)项下样品测定方法测定吸光度值并按照8)项下的公式计算多糖的含量,结果见表5。
从表5可以看出,三批次产品试样每一批次产品的多糖含量均1.47 g/100 g左右,且批次内的RSD值均小于2%,此方法准确、稳定、可靠。
4结果与意义
本研究结果表明,苯酚-硫酸分光光度法测定灵芝菌丝中多糖含量,在0~0.115 20 mg范围内线性关系良好,精密度RSD为1.42%。样品溶液在配制后12 h内稳定性较好,平均加标回收率为100.61%,RSD为0.97%。此方法适用于测定灵芝菌丝体中多糖含量。
灵芝菌丝含有与灵芝相同的多糖,同样具有广泛的生理活性和良好的应用前景,且通过发酵生产,产量大,周期短,常年可行,这使其很可能成为灵芝类产品开发的又一重点[14,18]。虽然目前灵芝多糖含量的测定方法有数种,但苯酚-硫酸分光光度法应用较为广发,且被收录于原食品质量检验检疫总局和农业部颁布的相关标准[14-18]。因而,在制定灵芝菌丝类产品统一的质量标准时,应优先采用苯酚-硫酸分光光度法测定其多糖的含量。
参考文献
[1]林志彬.灵芝的现代研究[M].北京:北京大学医学出版社,2015.
[2]吴学谦,付立忠,程俊文,等.灵芝品种的菌丝体多糖和三萜含量分析评价[J].中国林副特产,2009(5):1-4.
[3]Jiang J H,Slivova V,Harvey K,et al.Ganoderma lucidum suppress growth of breast cancer cells through the inhibition of A kt/N F kappa B signaling[J].Nutr Cancer,2004,49(2):209-216.
[4]林志彬,杨保学.灵芝的药理与临床[M].北京:北京大学医学出版社,2020.
[5]彭杨芷,苏悦,芦光亮,等.灵芝主要功效现代研究进展[J].亚太传统医药,2016,12(18):71.
[6]曹丽娟,朱建平,袁冰,等.我国早期对灵芝功用的研究[J].亚太传统医药,2013,9(5):67-69.
[7]林世和,谢岱,余南才.灵丹片中灵芝多糖的含量测定[J].时珍国医国药,2006,17(9):1715.
[8]杨瑞瑞,李国华,樊宝娟.灵芝多糖的含量测定方法探讨[J].陕西中医学院学报,2009,32(5):62-63.
[9]国家药典委员会.中华人民共和国药典:一部[M].北京:中国医药科技出版社,2020:195-196.
[10]白鸿.保健食品功效成分检测方法[M].北京:中国中医药出版社.2011.
[11]李成元,蔡晓.2种灵芝多糖含量测定方法的比较[J].中国药房,2009,20(18):1416-1417.
[12]戚雁飞.灵芝中灵芝多糖的含量测定研究[J].中国中药杂志,2006,10(31):852-853.
[13]国家药典委员会.中华人民共和国药典:四部[M].北京:中国医药科技出版社,2020:480-482.
[14]王守现,刘宇,许峰,等.灵芝菌丝体多糖含量比较及提取工艺研究[J].食品研究与开发,2011,32(10):13-15.
[15]曹西云,秦丕虎,温守功,等.灵芝菌合剂中灵芝多糖含量的测定[J].中国中医药信息杂志,2003,10(7):36-37.
[16]农业部.出口植物源食品中多糖的测定苯酚-硫酸法:NY/T 1676—2008[S].北京:中国农业出版社,2016:1-3.
[17]质量监督检验检疫总局.食用菌中多糖含量的测定:SN/T 4260—2015[S].北京:中国标准出版社版社,2008:1-3.
[18]单卫华,张玲,时延增,等.灵芝菌发酵液制剂中灵芝多糖及总糖含量测定[J].时珍国医国药,2000,9(11):797-798.
关注SCI论文创作发表,寻求SCI论文修改润色、SCI论文代发表等服务支撑,请锁定SCI论文网! 文章出自SCI论文网转载请注明出处:https://www.lunwensci.com/ligonglunwen/78014.html