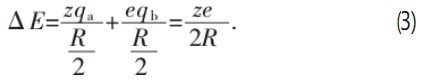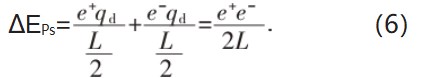SCI论文(www.lunwensci.com):
摘要:笔者对云南大学陈景教授的用经典力学计算氢分子键长、键能及力常数的理论模型进行推广,采用经典力学的方法,分别计算了氢原子和电子偶素的基态能量,得到的理论计算值分别为13.6 eV和6.8 eV,理论计算值与实验值一致。理论模型直观,计算方法简单且计算结果精确,同时未添加任何人为性的参数。
关键词:氢原子;电子偶素;基态能量;质子;电子;正电子;负电子
0引言
氢原子基态能量公式最先是玻尔借助于经典力学的方法推导出来的,它可以描述一个单电子氢原子在基态时的能量大小。基态能量公式是量子力学基础之一,通过对它的研究,可以进一步了解氢原子的原子核和电子的相互作用及性质。同时,这一理论也可以推广至电子偶素基态能量的计算。文献[1]中,云南大学陈景教授创造性地提出了氢分子成键结构模型,采用经典力学的方法,得出了三个简洁且漂亮的公式,完美地解决了氢分子的结构参数(氢分子键长、键能及力常数)。笔者对这一理论模型进行推广,借助陈教授的经典力学的方法,对氢原子和电子偶素的基态能量进行了计算,较好地解决了其基态能量问题。
1理论模型
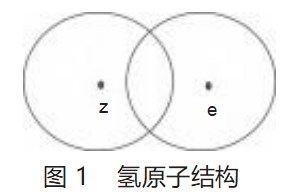
如图1所示,由于氢原子中质子和电子所带的电荷量相等,所以假定电子的场和质子的场体积相等[2],达到一种微秒的动态平衡。本文中笔者将电子的场或质子的场的球冠面称为电子场的壳或质子场的壳。在氢原子中,电子的场的壳吸引着质子,质子的场的壳吸引着电子从而达到这种微妙的动态平衡。
从力学的角度分析时,在某一特定的间距下,电子的场的壳对质子的吸引力等于质子的场的壳对电子的吸引力,此时体系处于相对平衡状态,此时的平衡间距R即为氢原子的半径。从能量的角度考察时,无论是电子的场的壳对质子的吸引,还是质子的场的壳对电子的吸引,氢原子获得了势能降,使氢原子能量降低了ΔE,即获得了氢原子的基态能量。即要将氢原子的电子和质子移动到间距为无限远时,必须提供这部分能量。
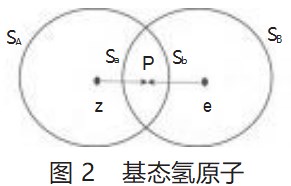
上述模型表明:如图2所示,在氢原子中,未进入交叠区的电子的场的壳SA不会对质子产生吸引,不会使其能量降低,因为其电子的场的壳对质子的吸引已被它自身的球壳所屏蔽。同理,质子的场的壳未进入交叠区的SB不会对电子产生吸引,同样不会使其能量降低。这种屏蔽影响,类似于微观时标中分析两能量降低。这种屏蔽影响,类似于微观时标中分析两个电子之间的排斥作用。
2氢原子和电子偶素基态能量的计算
2.1氢原子基态能量计算
直接计算电子的场的壳Sa对质子发生的势能降和电子的场的壳Sb对质子发生的势能降会非常复杂,但按照经典静电力学考虑时,可以先计算出Sa和Sb在质子和电子间距中点(图2中的P点)的等效电荷重心qa和qb,即电子的场的壳Sa对质子的静电吸引作用可用qa对质子的吸引作用代替;同理,即质子的场的壳Sb对电子的静电吸引作用可用qb对电子的吸引作用代替。然后用qa和qb计算形成氢原子时能量的变化。先从吸引力的关系求出等效电荷重心的值见式(1)—式(2)。
式中:z为质子电荷;e为电子电荷;R=0.529×10-10 m。已知qa和qb后,即可方便地计算氢原子基态能量ΔE[式(3)]:
经计算,氢原子的基态能量为13.6 eV,实验值为13.6 eV,理论计算值与实验值完全一致,无误差。
2.2电子偶素基态能量的计算
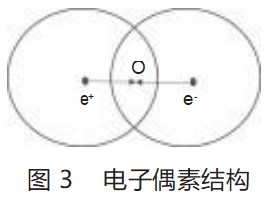
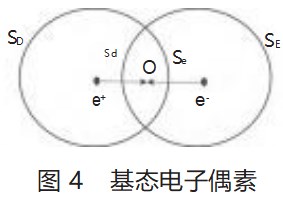
如图3所示,电子偶素是一个正电子和负电子形成的类似氢原子的束缚体系,元素符号为Ps[3]。由于电子偶素中正电子和负电子所带的电荷量相等,所以假定正电子的场和负电子的的场体积相等,且达到一种微妙的动态平衡。本文中,笔者将正电子的场或负电子的场的球冠面称为正电子场的壳或负电子场的壳。在电子偶素中,正电子的场的壳吸引着负电子,负电子的场的壳吸引着正电子,从而达到这种微妙的动态平衡。
从力学的角度分析时,在某一特定的间距下,正电子的场的壳对负电子的吸引力等于负电子的场的壳对正电子的吸引力,此时体系处于相对平衡状态,此时的平衡间距L即为电子偶素中正电子和负电子的间距。从能量的角度考察时,无论是正电子的场的壳对负电子的吸引,还是负电子的场的壳对正电子的吸引,电子偶素获得了势能降,使电子偶素能量降低了ΔEPs,即获得了电子偶素的基态能量。即要将电子偶素的正电子和负电子移动到间距为无限远时,必须提供这部分能量。
上述模型表明:如图3所示,在电子偶素中,未进入交叠区的正电子的场的壳SD不会对负电子产生吸引,不会使其能量降低,因为其正电子的场的壳对负电子的吸引已被它自身的球壳所屏蔽。同理,负电子的场的壳未进入交叠区的SE不会对正电子产生吸引,同样不会使其能量降低。这种屏蔽影响,类似于微观时标中分析两个电子之间的排斥作用。
直接计算正电子的场的壳Sd对负电子发生的势能降和负电子的场的壳Se对正电子发生的势能降会非常复杂,但按照经典静电力学考虑时,可以先计算出Sd和Se在正电子和负电子间距中点(图4中的O点)的等效电荷重心qd和qe,即正电子的场的壳Sd对负电子的静电吸引作用可用qd对负电子的吸引作用代替;同理,即负电子的场的壳Se对正电子的静电吸引作用可用qe对电子的吸引作用代替。然后用qd和qe计算形成电子偶素时能量的变化。先从吸引力的关系求出等效电荷重心的值。见式(4)—式(5)。
式中:e+为正电子电荷,e-为负电子电荷,L=1.058×10-10 m。
已知qd和qe后,即可方便地计算电子偶素基态能量ΔEPs[式(6)]:
经计算,电子偶素的基态能量为6.8 eV,实验值为6.8 eV,理论计算值与实验值完全一致,无误差。
3结果与讨论
云南大学陈景教授创造性地提出了氢分子成键结构模型,采用经典力学的方法,得出了三个简洁且漂亮的公式,完美解决了氢分子的结构参数(氢分子键长、键能及力常数)。笔者对这一理论模型进行推广,借助陈教授的经典力学的方法,对氢原子和电子偶素的基态能量进行了计算,较好地解决了其基态能量。得到的理论计算值分别为13.6 eV和6.8 eV,理论计算值与实验值一致。理论模型直观,计算方法简单且计算结果精确,同时未添加任何人为性的参数。这一结果表明,云南大学陈教授所提出的新的理论模型可以很好地推广,暗示物质结构和能量传递仍然可能暗藏着一些新的规律性[4-11]。
参考文献
[1]陈景.用经典力学计算氢分子的键长键能及力常数[J].中国工程科学,2003(6):39-43.
[2]何帅.计算氢原子第一电离能的一种新方法[J].杭州化工,2022,52(3):14-15.
[3]何帅.用宏观方法计算氢原子、氦原子、锂原子基态能量[J].广西物理,2022,43(1):44-46.
[4]何帅,侯秀芳.计算氢分子键能的一种新方法[J].广州化工,2018,46(5):30-32.
[5]何帅,李鑫盛,高晓明.计算碳碳单键键能的一种新方法[J].广州化工,2018,46(19):25-26.
[6]何帅.计算碳氢键键能的一种新方法[J].杭州化工,2021,51(3):22-23.
[7]何帅.计算氢原子半径的一种新方法[J].杭州化工,2021,51(1):39-40.
[8]何帅.计算碘原子半径的一种新方法[J].杭州化工,2021,51(2):26-27.
[9]何帅,李斌,田凤扬,等.计算碳原子半径的一种新方法[J]山东化工.2019,48(16):163-164.
[10]何帅.计算LiF、LiBr和LiI晶格能的一种新方法[J].四川化工,2023,26(2):6-9.
[11]何帅.一种计算NaF键能的新方法[J].山西化工,2023,43(6):26-27.
关注SCI论文创作发表,寻求SCI论文修改润色、SCI论文代发表等服务支撑,请锁定SCI论文网! 文章出自SCI论文网转载请注明出处:https://www.lunwensci.com/ligonglunwen/77995.html