SCI论文(www.lunwensci.com):
【摘要】目的: 探讨人参皂苷 Rh2 联合紫杉醇治疗人肝癌细胞 HepG2 和移植瘤小鼠的效果。方法:按照给药不同将人肝癌细胞 HepG2 分为紫杉醇组(40 mg/L 紫杉醇注射液)、人参皂苷组(20 mmol/L 人参皂苷 Rh2)、联合组(40 mg/L 紫杉醇注射液和20 mmol/L 人参皂苷 Rh2)和阴性对照组(培养液),比较四组人肝癌细胞 HepG2 活力、细胞迁移与侵袭数、细胞周期和增殖细胞核抗原(PCNA)、基质金属蛋白酶(MMP)-2、MMP-9 表达水平;再按照给药不同将移植瘤小鼠分为对照组(灌胃 0.2 mL 0.9% 氯化钠注射液)、紫杉醇组(腹腔注射 10 mg/kg 的紫杉醇注射液)、人参皂苷组(灌胃 10 mg/kg 的人参皂苷 Rh2 药液)和联合组(腹腔注射10 mg/kg 的紫杉醇注射液 + 灌胃 10 mg/kg 的人参皂苷 Rh2 药液),比较四组移植瘤小鼠的移植瘤质量和抑瘤率。结果:紫杉醇组、人参皂苷组、联合组 OD490 值均低于阴性对照组,人参皂苷组 OD490 值均高于紫杉醇组和联合组,差异有统计学意义(P<0.05);紫杉醇组、人参皂苷组和联合组细胞迁移与侵袭数均低于阴性对照组,且联合组低于紫杉醇组、人参皂苷组,差异有统计学意义(P<0.05);紫杉醇组、 人参皂苷组、联合组 G1 期细胞比例均高于阴性对照组,S 期、G2 期细胞比例均低于阴性对照组,且联合组 G1 期细胞比例高于紫杉醇组、人参皂苷组,S 期、G2 期细胞比例低于紫杉醇组、人参皂苷组,差异均有统计学意义(P<0.05);紫杉醇组、人参皂苷组、联合组 PCNA、MMP-2、MMP-9 表达水平均低于阴性对照组,且联合组低于紫杉醇组、人参皂苷组,差异均有统计学意义(P<0.05);紫杉醇组、人参 皂苷组及联合组小鼠移植瘤平均质量均低于阴性对照组,联合组抑瘤率高于紫杉醇组、人参皂苷组,差异均有统计学意义(P<0.05)。结论:人参皂苷 Rh2 联合紫杉醇可抑制人肝癌细胞 HepG2 增殖、侵袭与迁移,降低移植瘤小鼠移植瘤平均质量,提高抑瘤率,作用机制 可能与其能降低 PCNA、MMP-2、MMP-9 的表达水平有关。
【关键词】人肝癌细胞 HepG2;紫杉醇;人参皂苷 Rh2;细胞增殖;细胞侵袭;细胞迁移;移植瘤
Effects of Ginsenoside Rh2 combined with Paclitaxel on the proliferation, invasion and migration of hepatocellular carcinoma cells and study on its action mechanism
ZHANG Fenghai, ZHANG Ruirong, CHEN Shujuan, WANG Quanhong, YU Yonglan
(Department of Infectious Diseases of Ju County Traditional Chinese Medicine Hospital, Rizhao 276500 Shandong, China)
【 Abstract 】 Objective: To analyze effects of Ginsenoside Rh2 combined with Paclitaxel on the proliferation, invasion and migration of hepatocellular carcinoma cells and to study its action mechanism. Methods: According to the different drugs given, the human hepatocellular carcinoma HepG2 cells were divided into Paclitaxel group (40 µg/L Paclitaxel injection), Ginsenoside group (20 µmol/L Ginsenoside Rh2 injection), combined group (40 µg/L Paclitaxel injection and 20 µmol/L Ginsenoside Rh2 injection) and negative control group (culture medium). The human hepatocellular carcinoma HepG2 cell viability, cell migration and invasion number, cell cycle and the PCNA, MMP-2, MMP-9 protein expression levels were compared among the four groups. Further, according to the different drugs given, the transplanted tumor mice were divided into control group (0.2 mL 0.9% sodium chloride injection by gavage), Paclitaxel group (intraperitoneal injection of 10 mg/kg Paclitaxel injection), Ginsenoside group (10 mg/kg Ginsenoside Rh2 solution by gavage) and the combined group (intraperitoneal injection of 10 mg/kg Paclitaxel injection + 10 mg/kg Ginsenoside Rh2 solution by gavage). The transplanted tumor mass and tumor inhibition rate of the four groups were compared. Results: The OD490 values of the Paclitaxel group, Ginsenoside group, and combined group were lower than those of the negative control group; The OD490 value of the Ginsenoside group was higher than those of the Paclitaxel group and the combined group; and the differences were statistically significant (P<0.05). The cell migration and invasion numbers of the Paclitaxel group, Ginsenoside group and combined group were lower than those of the negative control group; the cell migration and invasion numbers of the combined group were lower than the Paclitaxel group and Ginsenoside group; and the differences were statistically significant (P<0.05). The proportions of G1 phase cells in the Paclitaxel group, Ginsenoside group, and the combined group were higher than that of the negative control group, and the proportions of cells in the S phase and G2 phase were lower than those in the negative control group; the proportion of G1 phase cells in the combined group was higher than those in the Paclitaxel group and Ginsenoside group, and the proportion of cells in S phase and G2 phase was lower than those in the Paclitaxel group and Ginsenoside group; and the differences were statistically significant (P<0.05). The protein expression levels of PCNA, MMP-2, and MMP-9 in the Paclitaxel group, Ginsenoside group, and combined group were lower than those of the negative control group; those of the combined group was lower than those of the Paclitaxel group and Ginsenoside group; and the differences were statistically significant (P<0.05). The average transplanted tumor masses in the Paclitaxel group, Ginsenoside group and the combined group were lower than that of the negative control group; the tumor inhibition rate of the combined group was higher than those of the Paclitaxel group and Ginsenoside group; and the differences were statistically significant (P<0.05). Conclusions: Ginsenoside Rh2 combined with Paclitaxel can inhibit the proliferation, invasion and migration of the hepatocellular carcinoma HepG2 cells, reduce the average transplanted tumor mass in the transplanted mice, and increase the tumor inhibition rate. Moreover, its action mechanism may be related to its ability to reduce the levels of PCNA, MMP-2 and MMP-9 in the hepatocellular carcinoma HepG2 cells.
【 Key words 】 Hepatocellular carcinoma HepG2 cell; Paclitaxel; Ginsenoside Rh2; Cell proliferation; Cell invasion; Cell migration; Transplanted tumor
0 引言
肝细胞癌(HCC)为临床常见肿瘤之一,国内每年死于 HCC 的患者超过 30 万,在恶性肿瘤中HCC 致死率仅次于肺癌 [1]。目前 HCC 患者术后 5 年生存率显著提高,但受癌细胞转移等影响,患者预后状况仍不理想 [2]。紫杉醇是 HCC 常用的化疗药物,但免疫抑制作用和肝毒性较大,使其使用受限 [3]。人参皂苷 Rh2 是人参主要抗癌有效成分,但其作用机制尚未完全明确 [4-5]。本文探讨人参皂苷Rh2 联合紫杉醇治疗人肝癌细胞 HepG2 和移植瘤小鼠的效果。
1 对象与方法
1.1 实验对象 BALB/c-nude 雌性裸鼠120 只,5~6 周龄,平均体质量(22.01±2.14)g,购自北京维通利华实验动物公司。
1.2 实验材料及试剂 (1)细胞株:人肝癌细胞 HepG2(上海细胞生物研究所)。(2)药物及试剂:人参皂苷 Rh2(纯度 99.69%,浙江海正制药公司),紫杉醇注射液(海南海药股份有限公司,国药准字 20043122,5 mL ∶ 30 mg),胰蛋白酶、Western 专用一抗与二抗稀释液(江苏碧云天公司),DMEM(高糖)培养基、无血清培养液、20% 胎牛血清(FBS)(美国 Gibco 公司),放射免疫沉淀(RIPA)蛋白裂解液(江苏碧云天公司), Matrigel 基质胶(美国 BD 公司),纤维连接蛋白溶液(赛默飞公司),电化学发光(ECL)试剂盒(美国Pierce Biology 公司),细胞周期检测试剂盒(凯基生物公司)。(3)仪器:IX-71 荧光倒置显微镜与 BX53 正置显微镜(日本 Olympus 光学工业株式会社),37 ℃电恒温水浴箱(济南欧莱博科学仪器公司),流式细胞仪(赛默飞公司),洁净工作台(江苏苏州安泰公司),Powerpac164-5070 电泳仪(美国 Bio-Rad 公司),Infinite M1000 PRO 多功能酶标仪(瑞士Tecan 公司),CO2 细胞培养箱(美国 Thermo Fisher Scientific 公司),LAS4000Mini 型化学发光成像分析仪(美国 GE 公司)。
1.3 方法 (1)细胞培养:人肝癌细胞 HepG2 于 37 ℃电恒温水浴箱内快速解冻,在 20% FBS 高糖 DMEM 培养基(200 mmol/L 谷氨酰胺、100 mg/L 链霉素、100 U/L 青霉素)内培养,放置在 5% CO2、37 ℃饱和湿度细胞培养箱内培养传代。(2) 实验分组:按照给药不同将人肝癌细胞 HepG2 分为紫杉醇组、人参皂苷组、联合组及阴性对照组。(3)四甲基偶氮唑盐微量酶反应比色(MTT)法检测各组细胞活力:取对数生长期细胞经 0.25% 胰蛋白酶消化后制备为单细胞悬液,以 200 μL 每孔接种于 24 孔培养板,细胞数为 5×107/L。在 5% CO2、37 ℃培养箱内培养,细胞贴壁后各组置入对应药物,紫杉醇组加入 40 mg/L 的紫杉醇注射液, 人参皂苷组加入 20 mmol/L 的人参皂苷 Rh2,联合组加入 40 mg/L 的紫杉醇和 20 mmol/L 的人参皂苷Rh2,阴性对照组置入培养液。每组设立 6 个复孔, 培养 20 h 时分别置入 5 g/L 的 MTT 溶液,而后继续培养 4 h。结束培养后吸出上清液,每孔置入二
甲基亚砜 150 μL,避光震动 10 min,酶标仪进行吸光度读数,读取 OD490 吸光度值。(4)Transwell 小室检测各组细胞迁移情况:取对数生长期细胞经 0.25% 胰蛋白酶消化后制备为单细胞悬液,细胞密度 1.0×105 个 /mL,Transwell 小室放于 24 孔板中,Transwell 小室中加入 100 μL 单细胞悬液,对照组置入培养液,其他组置入对应药物,每组 6 个复孔。下室内置入含 20% FBS 500 μL,5% CO2、37 ℃培养箱内培养 24 h,结晶紫染色后磷酸盐缓
冲液(PBS)冲洗。显微镜下计数,选取 3 个视野取平均值。(5)Transwell 小室检测各组细胞侵袭情况:取对数生长期细胞经 0.25% 胰蛋白酶消化后制备为单细胞悬液,Transwell 小室放于 24 孔板中, Transwell 小室内置入 30 μL 融化稀释的 Matrigel 基质胶,37 ℃下孵育 2 h;用 10 mg/L 纤维连接蛋白溶液 50 μL 包被小室反面,风干。细胞密度调整为 1×105 个 /mL,在小室内加入 100 μL,对照组置入培养液,其他各组置入对应药物,每组 6 个复孔。500 μL 含 20% FBS 培养液置入 Transwell 小室的下室。5% CO2、37 ℃培养箱内培养 24 h,擦去未侵袭细胞,结晶紫染色后 PBS 冲洗。显微镜下计数,选取 3 个视野取平均值。(6)流式细胞仪检测细胞周期:取对数生长期细胞经 0.25% 胰蛋白酶消化为单细胞悬液,24 孔细胞培养板种植,加入浓度为 1×105 个 /mL 细胞悬液 100 μL,细胞贴壁后每组分别加入培养液和对应药物,每组 6 个复孔,培养 24 h 后采用细胞周期检测试剂盒检测细胞周期情况,流式细胞仪分析。(7)Western blot 法检测增殖细胞核抗原(PCNA)、基质金属蛋白酶(MMP)-2、MMP-9 表达水平:选取对数期细胞制备为单细胞悬液,计数后接种于 24 孔板内,1×106 个 / 孔。细胞贴壁后培养至融合度为 80% 时,更换无血清培养基。对照组置入培养液,其他各组置入对应药物,每组 6 个复孔,在培养箱内培养 24 h,培养基弃去后采用 PBS 洗涤两次,细胞裂解液置入后将贴壁细胞刮下,15 000 r/min(离心半径 6 cm)离心 10 min,去上清液得细胞总蛋白,二喹啉甲酸(BCA)检测细胞总蛋白;采用十二烷基硫酸钠 - 聚丙烯胺凝胶电泳法电泳后转膜,配制 5% 脱脂奶粉用聚偏二氟乙烯膜封闭,在37 ℃的摇床放置 2 h;依次加入 1 ∶ 1000 稀释的PCNA、MMP-2、MMP-9 抗体,4 ℃孵育过夜;再 置入 1 ∶ 1000 稀释的二抗,在 37 ℃下孵育 2 h; 膜上条带对应位置涂抹 ECL 显影液,曝光后应用Image J 图像分析软件分析结果,检测各条带灰度值, 灰度值越高,蛋白表达越强。(8)构建裸鼠移植瘤模型:取对数生长期细胞经 0.25% 胰蛋白酶消化后制备为单细胞悬液(5.0×106/0.2 mL),每只小鼠右腋窝接种 200 mL。待瘤体直径达 0.7~1.1 cm 时将小鼠分为四组,分别为对照组(灌胃 0.2 mL 0.9% 氯化钠注射液)、紫杉醇组(腹腔注射 10 mg/kg 的紫杉醇注射液)、人参皂苷组(灌胃 10 mg/kg 的人参皂苷 Rh2 药液)和联合组(腹腔注射 10 mg/kg 的紫杉醇注射液 + 灌胃 10 mg/kg 的人参皂苷 Rh2 药液),1 次 /d,持续给药 21 d。
1.4 观察指标 (1)比较四组人肝癌细胞 HepG2 活力。(2)比较四组人肝癌细胞 HepG2 迁移与侵袭数。(3)比较四组人肝癌细胞 HepG2 周期。(4) 比较四组人肝癌细胞 HepG2 中 PCNA、MMP-2、MMP-9 表达水平。(5)所有小鼠停药 2 d 后断颈处死,取出移植瘤并称重,比较四组移植瘤小鼠移植瘤质量和抑瘤率。
1.5 统计学方法 应用 SPSS 21.0 软件进行统计学分析,计量资料以(x—±s)表示,采用 t 检验,以 P<0.05 为差异有统计学意义。
2 结果
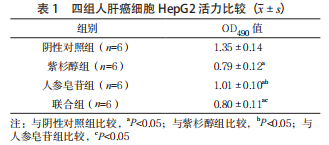
2.1 四组人肝癌细胞 HepG2 活力比较 紫杉醇组、人参皂苷组、联合组 OD490 值均低于阴性对照组, 且人参皂苷组 OD490 值均高于紫杉醇组和联合组, 差异有统计学意义(P<0.05);紫杉醇组和联合组OD490 值比较,差异无统计学意义(P>0.05)。见表 1。
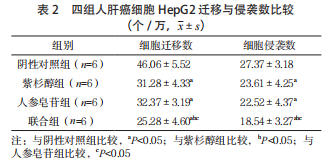
2.2 四组人肝癌细胞 HepG2 迁移与侵袭情况比较 紫杉醇组、人参皂苷组和联合组细胞迁移与侵袭数均低于阴性对照组,且联合组低于紫杉醇组、人参皂苷组,差异有统计学意义(P<0.05);紫杉醇组和人参皂苷组细胞迁移与侵袭数比较,差异均无统计学意义(P>0.05)。见表 2。
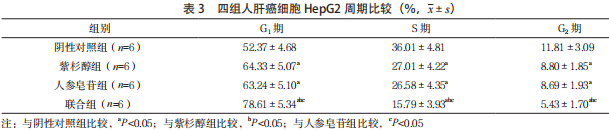
2.3 四组人肝癌细胞 HepG2 周期比较 紫杉醇组、人参皂苷组、联合组 G1 期细胞比例均高于阴性对照组,S 期、G2 期细胞比例均低于阴性对照组,且联合组 G1 期细胞比例高于紫杉醇组、人参皂苷组, S 期、G2 期细胞比例低于紫杉醇组、人参皂苷组, 差异均有统计学意义(P<0.05);紫杉醇组和人参皂苷组 G1 期、S 期和 G2 期细胞比例比较,差异均无统计学意义(P>0.05)。见表 3。
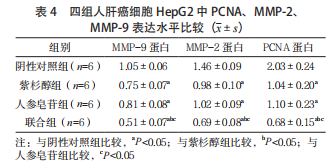
2.4 四组人肝癌细胞 HepG2 中 PCNA、MMP-2、MMP-9 表达水平比较 紫杉醇组、人参皂苷组、联合组细胞 PCNA、MMP-2、MMP-9 表达水平均低于阴性对照组,且联合组低于紫杉醇组和人参皂苷组,差异均有统计学意义(P<0.05);紫杉醇组和人参皂苷组 PCNA、MMP-2、MMP-9 表达水平比较,差异均无统计学意义(P>0.05)。见表 4、图 1。
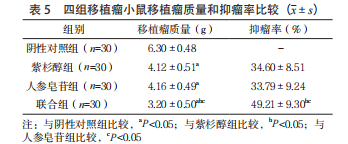
2.5 四组移植瘤小鼠移植瘤质量和抑瘤率比较 紫杉醇组、人参皂苷组及联合组小鼠移植瘤平均质量均低于阴性对照组,联合组抑瘤率高于紫杉醇组、人参皂苷组,差异均有统计学意义(P<0.05);紫杉醇组和人参皂苷组移植瘤平均质量和抑瘤率比较,差异均无统计学意义(P>0.05)。 见表 5。
3 讨论
紫杉醇有广谱抗癌活性,在肺癌、肝癌、乳腺癌等肿瘤治疗中应用广泛,其主要通过破坏微管蛋白与微管间的动态平衡,进而起到抗肿瘤作用 [6]。但紫杉醇在杀伤癌细胞的同时也会对机体正常细胞造成损伤,不良反应较多。
细胞增殖为生物体主要生理特点,正常细胞中存在能够调节细胞增殖周期的 G1/S 期阻滞点,而一旦丧失 G1/S 期阻滞点的调控功能,则会造成细胞增殖失控而引发癌变。紫杉醇可抑制肿瘤细胞的分裂与增殖,使肿瘤细胞同步为 G2/M 期,进而起到抗癌作用。人参中的人参皂苷 Rh2 具有调节心血管功能、提高免疫力等作用,可抑制癌细胞转移, 阻滞细胞周期,诱导癌细胞分化及凋亡,且毒性比较低,为联合化疗的理想药物[7-8]。本研究结果显示, 紫杉醇组、人参皂苷组、联合组 OD490 值均低于阴性对照组,人参皂苷组 OD490 值均高于紫杉醇组和联合组;细胞迁移与侵袭数均低于阴性对照组,且联合组细胞迁移与侵袭数低于紫杉醇组、人参皂苷组;紫杉醇组、人参皂苷组、联合组 G1 期细胞比例均高于阴性对照组,S 期、G2 期细胞比例均低于阴性对照组,且联合组 G1 期细胞比例高于紫杉醇组、人参皂苷 Rh2 组,S 期、G2 期细胞比例低于紫杉醇组、人参皂苷 Rh2 组;紫杉醇组、人参皂苷组及联合组小鼠移植瘤平均质量均低于阴性对照组, 联合组抑瘤率高于紫杉醇组、人参皂苷组。提示人参皂苷 Rh2 与紫杉醇联用可发挥抑癌的协同增效作用。
癌细胞侵袭转移中一个关键环节为细胞外基质损伤,而基质金属蛋白酶(MMP)是机体内最为主要的蛋白水解酶,能够破坏细胞外基质。在癌细胞的侵袭与转移中,MMP-2、MMP-9 不但能使细胞间基质成分降解,还能使基底膜中Ⅳ型胶原降解,加速癌细胞浸润至周边组织,并造成癌细胞远处转移与局部浸润 [9]。肝癌和癌旁组织内 MMP-2、MMP-9 的表达水平能作为肝癌侵袭与转移的主要判别指标之一 [10]。PCNA 是癌细胞增殖生物学标志物,在肝癌细胞增殖的维持中发挥重要作用 [11]。本研究结果同时显示,紫杉醇组、人参皂苷组、联合组 PCNA、MMP-2、MMP-9 表达水平均低于阴性对照组,且联合组低于紫杉醇组和人参皂苷组。提示人参皂苷 Rh2 联合紫杉醇对肝癌细胞侵袭与转移的抑制作用可能与其能降低 PCNA、MMP-2、MMP-9 的表达水平有关。
综上所述,人参皂苷 Rh2 联合紫杉醇可抑制人肝癌细胞 HepG2 增殖、侵袭与迁移能力,降低移植瘤小鼠移植瘤平均质量,提高抑瘤率,作用机制可能与其能降低 PCNA、MMP-2、MMP-9 的表达水平有关。
参考文献
[1]Lv Q,Rong N,Liu LJ,et al. Antitumoral Activity of(20R)- and(20S)-Ginsenoside Rh2 on Transplanted Hepatocellular Carcinoma in Mice[J]. Planta Med,2016,82(8):705-711.
[2]Ren ZG,Chen XM,Hong LJ,et al. Nanoparticle Conjugation of Ginsenoside Rg3 Inhibits Hepatocellular Carcinoma Development and Metastasis[J]. Small,2020,16(2):e1905233.
[3]Li Q,Li B,Dong CY,et al. 20(S)-Ginsenoside Rh2 suppresses proliferation and migration of hepatocellular carcinoma cells by targeting EZH2 to regulate CDKN2A-2B gene cluster transcription[J]. Eur J Pharmacol,2017(815):173-180.
[4]马红霞,白文梅 . 人参皂苷 Rh_2 联合化疗用于肺癌的疗效评价及对肿瘤标志物和免疫功能的影响 [J]. 空军医学杂志, 2019,35(5):406-409.
[5]石庆强,左国伟,冯子强,等 . 人参皂苷 Rh2 通过激活 GSK- 3β 降解 β-catenin 发挥抗肝癌作用研究 [J]. 中草药,2016, 47(18):3231-3238.
[6]Zhu DW,Wu SJ,Hu CY,et al. Folate-targeted polymersomes loaded with both paclitaxel and doxorubicin for the combination chemotherapy of hepatocellular carcinoma[J]. Acta Biomater,2017(58):399-412.
[7]黄容容,钱颖,向明. 人参皂苷Rh2 免疫调节作用研究进展[J]. 中国免疫学杂志,2019,35(23):2936-2941.
[8]Lee KY,Park JA,Chung E,et al. Ginsenoside-Rh2 blocks the cell cycle of SK-HEP-1 cells at the G1/S boundary by selectively inducing the protein expression of p27kip1[J]. Cancer Letters, 1996,110(12):193-200.
[9]Li Y,Xiao Z,Li B,et al. Ginsenoside exhibits concentration- dependent dual effects on HepG2 cell proliferation via regulation of c-Myc and HNF-4α[J]. Eur J Pharmacol,2016(792):26-32.
[10]Lu M,Fei Z,Zhang G. Synergistic anticancer activity of 20(S)-Ginsenoside Rg3 and Sorafenib in hepatocellular carcinoma by modulating PTEN/Akt signaling pathway[J]. Biomed Pharmacother,2018(97):1282-1288.
[11]刘亚珠,李京涛,魏海梁,等 . 益脾养肝方对大鼠肝癌癌前病变组织 PCNA、GGT 蛋白表达的影响 [J]. 陕西中医,2017, 38(2):264-266.
关注SCI论文创作发表,寻求SCI论文修改润色、SCI论文代发表等服务支撑,请锁定SCI论文网!
文章出自SCI论文网转载请注明出处:https://www.lunwensci.com/yixuelunwen/32997.html