SCI论文(www.lunwensci.com):
摘要:目的本文对氧氟沙星滴眼剂无菌以及灭菌工艺验证方面进行了研究和分析,以保证生产过程中产品的无菌。方法通过对产品的生产线路的灭菌、药液的灭菌以及灌装等环节进行了灭菌工艺验证的研究。结果每批产品灭菌前后药液均符合规定。结论通过上述灭菌过程,能够确保生产过程不偏离设计要求,从而确保产品质量。
关键词:氧氟沙星滴眼剂;灭菌
本文引用格式:韩杨,高海鹰.氧氟沙星滴眼剂无菌保证水平验证和评估[J].世界最新医学信息文摘,2019,19(93):311.
Verification and Evaluation of Aseptic Assurance Level of Ofloxacin Eye Drops
HAN Yang,GAO Hai-ying
(Jilin Medical device inspection institute,Changchun Jilin)
ABSTRACT:Objective To study and analyze the sterility of ofloxacin eye drops and the verification of sterilization process in order to ensure the sterility of products in the production process.Methods The sterilization process of the product,the sterilization of liquid medicine and filling were studied.Results The solution of each batch of products before and after sterilization meets the requirements.Conclusion The above sterilization process can ensure that the production does not deviate from the design,and can ensure product quality.
KEY WORDS:Ofloxacin eye drops;Sterilization
0引言
国家食品药品监督管理局要求眼用液体制剂必须在2013年12月31日前通过新版GMP认证,眼用液体制剂列为无菌制剂后,并验证了灭菌过程能够确保本品的无菌保证水平,从而保证产品质量。本文从产品生产线路的灭菌、药液的灭菌和灌装等环节进行了灭菌工艺验证,以能够确保本品的无菌保证水平,从而保证产品质量[1]。在药液配制前,对配料罐、输液管路和灌装系统进行灭菌[2],确保无菌保证水平不高于10-6。
1仪器设备
300L配料罐:上海日泰医药设备工程有限公司,生物指示剂-嗜热脂肪杆菌芽孢(ATCC7953):上海福泽医药器材有限公司。
2实验部分
2.1生产线路的灭菌及验证
生产线路的灭菌:产品生产前对配料罐、输药管路、中储罐、滤器等进行灭菌,生产制备前生产线路的灭菌方式:在产品制备前,用纯化水及注射用水将配料罐、输药管路、中储罐及滤器清洗干净后,采用纯蒸汽发生器作为灭菌介质对生产线路进行灭菌。灭菌温度为121℃(末端排气口不低于121℃,罐内温度不低于125℃、不高于134℃),灭菌时间20分钟。灭菌完成后用经除菌过滤的压缩空气对生产线路进行吹干,在保持正压下关闭阀门,使生产线路处于正压状态[3-4]。
生产线路灭菌验证:进行生产线路灭菌验证时,采用热分布测试和生物指示剂挑战试验同步进行的方式,结果均达到了设定标准,可以保证灭菌的有效性。
2.2产品配制过程灭菌及验证
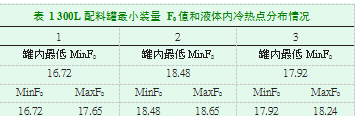
在进行配料罐药液灭菌过程确认时,热力学测试和生物指示剂试验同步进行。验证方法为将温度传感器和生物指示剂固定于专用支架上,兼顾了罐内的各个位置。升温,于121℃灭菌10分钟,配料罐进行3次测试。进行了三次挑战试验,阳性对照24小时培养生长良好。配料罐内所有测试点的F0值均大于要求的10。液体内的温度均匀度,均小于2℃。F0值和每个配料罐的液体内冷热点情况分别见表1。
2.3药液质量均一性的验证
与灭菌柜灭菌不同的是,药液在配料罐中灭菌过程中,搅拌一直处于开启状态,药液被不断搅拌、运动,因此无法获得冷点和热点的药液进行检测。在工艺验证时,需要对药液质量进行均一性验证。
验证方法为取灭菌前药液、中间产品(灭菌后灌装前药液)、灌装开始后3个不同取样点药液和成品,分别检测主药含量和羟苯乙酯含量。结果每批产品灭菌前后药液均符合规定。表明产品质量均一性良好。
2.4灭菌后中储、抽样,灌装步骤的无菌保证方法
中间产品取样在B级区进行,从中储罐罐底通过取样阀放料取样。培养基无菌模拟灌装时模拟了中间产品的取样过程,其结果符合要求也间接证明了取样过程不会对中储罐内的药液造成污染。
2.5灌装
灌装操作在B级洁净区A级层流下进行。生产线已经进行过培养基无菌模拟灌装验证,且验证结果符合规定,表明该生产线可以进行无菌产品的灌装,因此能够保障药液灌装过程中的无菌水平。
3结论
根据本品主成份氧氟沙星及所用的辅料对热稳定的性质,灭菌结果表明药液在配料罐中灭菌对产品性状、主成份含量、防腐剂含量、有关物质均没有影响,灭菌后无新的杂质增加,产品各项质量指标均未发生显著变化,稳定性良好,本品可以采用湿热灭菌工艺生产。
参考文献
[1]张新,张癸荣,胡昌勤.中国药典2003年版滴眼剂项下若干问题的探讨[J].解放军药学学报,2008,19(4):314-315
[2]张青.玻璃酸钠滴眼液原料分子量和灭菌条件的筛选[D].山东大学,2014.
[3]叶明.滴眼剂(塑瓶三件套)生产联动线[J].机电信息,2015,17:63.
[4]郭喜宝,刘利国.HPLC法测定蓝金滴眼液中绿原酸含量的研究[J].实用中医内科杂志,2007,21(8):22.
关注SCI论文创作发表,寻求SCI论文修改润色、SCI论文代发表等服务支撑,请锁定SCI论文网! 文章出自SCI论文网转载请注明出处:https://www.lunwensci.com/yixuelunwen/25021.html