SCI论文(www.lunwensci.com):
摘要:目的观察噻托溴铵联合沙美特罗/氟替卡松治疗哮喘-慢阻肺重叠综合征(ACOS)的临床疗效。方法选取2017年7月至2017年12月我院收治的70例ACOS住院患者,采用随机数字表法分为观察组(n=35)和对照组(n=35)。观察组患者给予噻托溴铵联合沙美特罗/氟替卡松治疗,对照组患者给予单独沙美特罗/氟替卡松治疗。比较两组患者治疗前后的炎症反应标志物、肺通气功能、COPD评估测试量表(CAT)评分、哮喘控制测试量表(ACT)评分的差异。结果治疗后与对照组相比,观察组患者白细胞介素-8(IL-8)、白细胞介素-13(IL-13)、白细胞介素-17(IL-17)、超敏C-反应蛋白(hs-CRP)、肿瘤坏死因子-α(TNF-α)和血嗜酸性粒细胞计数(EOS)水平和CAT评分均明显降低,白细胞介素-10(IL-10)水平和ACT评分明显升高,肺通气功能明显改善,差异均有统计学意义(P<0.05)。观察组患者的临床总有效率高于对照组(91.43%vs 80.00%,2=5.285,P<0.05)。结论噻托溴铵联合沙美特罗/氟替卡松能显著改善ACOS患者的炎性反应和肺通气功能,并缓解其临床症状,疗效令人满意。
关键词:噻托溴铵;沙美特罗;氟替卡松;哮喘-慢阻肺重叠综合征;临床疗效
本文引用格式:瞿美君.噻托溴铵联合沙美特罗/氟替卡松治疗哮喘-慢阻肺重叠综合征的临床效果观察[J].世界最新医学信息文摘,2019,19(66):230-232.
0引言
哮喘-慢阻肺重叠综合征(asthma COPD overlap syndrome,ACOS)是呼吸系统疾病常见疾病,好发于中老年人群,以慢性咳嗽、喘息、呼吸困难等为主要表现,可引起肺功能持续下降[1]。近年来,因环境污染和人口老龄化等问题,我国ACOS的发病率明显上升,对人们健康和生活质量造成了极大的影响[2]。目前,临床治疗ACOS以糖皮质激素(inhaled corticosteroid,ICS)、长效β2受体激动剂(long acting beta-agonists,LABA)以及长效毒蕈碱受体拮抗剂等药物治疗为主。又因ACOS同时具备哮喘及COPD的部分特征,全球哮喘防治创议[3]建议ACOS患者使用联合吸入治疗,避免单独使用支气管舒张剂。噻托溴铵是临床常用的支气管舒张剂,能选择性平滑肌M3受体,扩张支气管。沙美特罗/氟替卡松属于β2受体激动剂和糖皮质激素的混合物,对COPD患者的气道阻力有显著改善效果[4]。本研究选取我院收治的70例ACOS患者,分别给予噻托溴铵联合或单独沙美特罗/氟替卡松治疗,探讨联合治疗对ACOS患者肺通气功能和炎症相关指标的影响,为临床用药提供参考。
1资料与方法
1.1一般资料
选取2017年7月至2017年12月期间我院呼吸内科收治的70例ACOS住院患者作为研究对象,采用随机数字表法分为观察组和对照组,每组35例。观察组患者中男22例,女13例;年龄19~75岁,平均(46.78±8.84)岁;哮喘病程2~12年,平均(4.46±0.72)年;慢阻肺病程5~19年,平均(9.54±4.36)年。临床症状体征:呼吸困难9例、咯痰18例、复发性咳嗽9例、呼吸道感染4例;合并基础疾病:高血压6例、冠心病6例、糖尿病13例。对照组患者中男23例,女12例;年龄24~73岁,平均(47.97±9.12)岁;哮喘病程1~14年,平均(4.62±0.98)年;慢阻肺病程6~22年,平均(9.87±4.74)年。临床症状体征:呼吸困难9例、咯痰18例、复发性咳嗽9例、呼吸道感染4例;合并基础疾病:高血压6例、冠心病6例、糖尿病13例。纳入标准:(1)符合《慢性阻塞性肺疾病诊治指南》[5]和《哮喘-慢性阻塞性肺疾病重叠综合征的诊治进展》[6]中关于ACOS的临床诊断标准。(2)对研究治疗药物无禁忌或过敏史。(3)临床资料完整,患者全程配合治疗及相关检查。排除标准:(1)合并肺炎、支气管扩张症等其它呼吸系统疾病者。(2)既往有胸部、肺部手术史者。(3)合并心、肝、肾等疾病者。(4)合并自身免疫性疾病者。(5)精神、神经性疾病或交流障碍者。本组研究纳入两组患者的一般资料比较无统计学意义(P>0.05),具有可比性。
1.2治疗方法
两组患者均给予吸氧、营养支持等常规基础治疗。在此基础上,对照组患者给予单纯沙美特罗或氟替卡松治疗,每次1吸(50g沙美特罗和100g氟替卡松),每日1次。观察组患者在对照组基础上加用噻托溴铵治疗噻托溴铵,18g/次,1次/d。4周为一个疗程,两组患者均治疗8周。
1.3观测指标
1.3.1炎症反应标志物
分别于治疗前后取患者清晨空腹静脉血,采用酶联免疫吸附测定法检测其血清炎性因子水平,包括白细胞介素-8(interleukin-8,IL-8)、白细胞介素-10(interleukin-10,IL-10)、白细胞介素-13(interleukin-13,IL-13)、白细胞介素-17(interleukin-17,IL-17)、超敏C-反应蛋白(hypersensitive C-reactive protein,hs-CRP)、肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α);全自动血细胞分析仪进行血嗜酸性粒细胞计数(Eosinophil Cell Count,EOS)。
1.3.2肺通气功能
分别于治疗前后采用肺功能测试仪测量两组患者的肺通气功能,包括第1秒用力呼气容积(Forced expiratory volume in one second,FEV1)、用力肺活量(forced vital capacity,FVC)、第1秒用力呼气容积占用力肺活量百分比(FEV1/FVC)、FEV1预测值(FEV1 predicted,FEV1%)、最大呼气中段流量(maximal mid-expiratory flow curve,MMEF)。
1.3.3临床疗效
参考《支气管哮喘防治指南》[7]中的相关评价标准,显效:临床症状和气道炎性反应缓解,肺功能明显改善;有效:临床症状、气道炎性反应和肺功能有好转;无效:临床症状、气道炎性反应和肺功能无改善或加重。
1.3.4CAT、ACT评分
分别于治疗前后采用哮喘控制测试评分(ACT)及慢性阻塞性肺疾病评分表(CAT)评估两组患者的病情变化。ACT共5个问题,患者根据过去1个月的并发情况进行回答。评分采用0~5分累计,总分0~25分,分值越高,表明患者哮喘病情控制越好。CAT量表包括6项主要指标,共8个问题。评分采用0~5分累计,总分0~40分。分值越高,表明患者慢性阻塞性肺病情越严重。
1.4统计学方法
采用SPSS 19.0统计软件,符合正太分布的计量资料用均数±标准差(±s)表示,组间比较采用两独立样本t检验。计数资料用率(%)表示,采用2检验。P<0.05为差异有统计学意义。
2结果
2.1两组患者治疗前后的炎症反应标志物水平
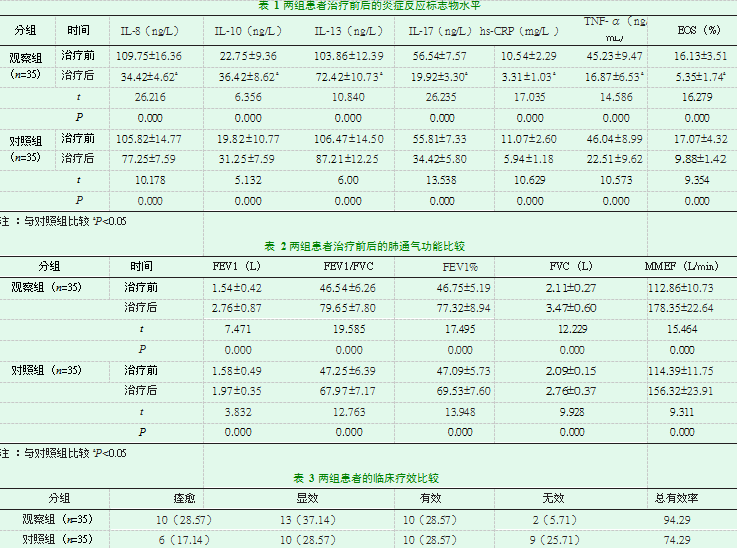
治疗前,两组患者的IL-8、IL-10、IL-13、IL-17、hs-CRP、TNF-α、EOS比较无统计学意义(P>0.05);治疗后,两组患者的IL-8、IL-13、IL-17、hs-CRP、TNF-α、EOS均较治疗前显著降低,IL-10则显著升高,差异有统计学意义(P<0.05)。同时,观察组治疗后上述指标较对照组均有明显改善,差异有统计学意义(P<0.05)。见表1。
2.2两组患者治疗前后的肺通气功能比较
治疗前,两组患者的FEV1、FVC、FEV1/FVC、FEV1%、MMEF比较无统计学意义(P>0.05);治疗后,两组患者的FEV1、FVC、FEV1/FVC、FEV1%、MMEF均较治疗前明显升高差异有统计学意义(P<0.05)。同时,观察组治疗后上述指标较对照组均有明显改善,差异有统计学意义(P<0.05)。见表2。
2.3两组患者的临床疗效比较
治疗后观察组患者的临床总有效率为94.29%(33/35),高于对照组患者的74.29%(26/35),差异有统计学意义(2=5.285,P<0.05)。见表3。
2.4两组患者治疗前后的CAT、ACT评分比较
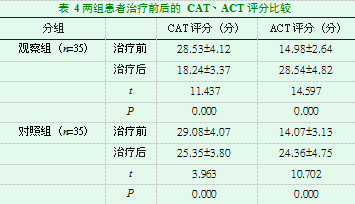
治疗前,两组患者的CAT、ACT评分比较无统计学意义(P>0.05);治疗后,两组患者的CAT评分明显降低,ACT评分明显升高,差异有统计学意义(P<0.05),同时,观察组治疗后CAT、ACT评分较对照组均有明显改善,差异有统计学意义(P<0.05)。见表4。
3讨论
ACOS是世界卫生组织提出的一种新型呼吸系统疾病,由哮喘和COPD在特殊的机体环境下相互影响和转化产生。因此,ACOS同时具备哮喘和COPD临床症状,但因其发病机制、病因病理、诊断治疗与两种疾病略有差异,故又将其独立于两种疾病之外[8]。有研究显示,ACOS的发生发展与机体变态反应、嗜酸性粒细胞计数、炎症反应和中性粒细胞等密切相关,且COPD发展成为ACOS后,患者肺功能迅速下降,炎症反应明显加重[9]。因此,ACOS的防治以缓解气道阻力、改善炎症反应和肺功能为主。
ICS、LABA、长效毒蕈碱受体拮抗剂和支气管舒张剂是目前临床治疗ACOS主要药物。噻托溴铵作为一种长效毒蕈碱受体拮抗剂,能特异选择性抑制平滑肌M胆碱受体(M1、M2、M3)的生物活性,抑制乙酰胆碱对平滑肌的收缩作用,改善支气管平滑肌痉挛和纤毛运动能力,持久、强效的扩张支气管和加快气流运动[10]。另外,噻托溴铵对气道炎症反应也有显著的抑制效果。噻托溴铵能保持气道长期开放,减少气道的反复塌陷和开放以及气道组织间的摩擦,阻止气道炎症的发生。此外,噻托溴铵还能抑制5-羟二十碳四烯酸、中性粒细胞和嗜酸粒细胞等趋化活性物质的释放,减少气道分泌物,防止气道堵塞[11]。沙美特罗/氟替卡松作为β2受体激动剂和糖皮质激素的混合物,能在多种机制方向上协同增效,提高两种药物的应用效果[12]。沙美特罗是一种典型的β受体阻滞剂,在到达病灶部位后选择性地与β2受体结合,增加细胞内环磷酸腺苷(cyclic Adenosine Monophosphatec,cAMP)浓度,长时间舒张支气管平滑肌;降低血管通透性,缓解气道肿胀,促进支气管黏液分泌和纤毛运动,改善机体肺功能[13]。此外,沙美特罗还能刺激糖皮质激素受体向细胞核的移位以及糖皮质激素受体敏感基因的转录,提高细胞的抗炎活性。氟替卡松则通过炎症因子调控靶细胞的基因转录,抑制多种炎性细胞的活化及炎性因子的合成分泌,增加呼吸道中β受体的数量,同时提高机体对β2受体的敏感性[14]。本研究中,给予ACOS患者噻托溴铵联合沙美特罗/氟替卡松治疗后,其临床疗效明显高于单独沙美特罗/氟替卡松治,提示噻托溴铵联合沙美特罗/氟替卡松对ACOS有显著的治疗效果。
炎症反应贯穿ACOS发生发展的全程,是ACOS临床诊断的重要指标之一。IL-8能吸引和激活中性粒细胞定向聚集至反应部位,并释放一系列活性产物,促使机体发生局部炎症反应,损伤支气管黏膜上皮细胞[15]。IL-10参与调节呼吸道合胞病毒过度促炎细胞因子和趋化因子,与慢阻肺组关系密切;IL-13能刺激嗜酸性粒细胞的生物活性和参与LgE的合成,诱导哮喘发生;IL-17参与中性粒细胞炎症反应,介导COPD疾病的发生与发展;hs-CRP是检测机体炎症反应最灵敏的指标之一;TNF-α主要由单核巨噬细胞分泌,能促进气道炎症和气道重塑等,并在气道平滑肌细胞增殖、纤维细胞生长和肌成纤维细胞成熟等方面具有重要作用[16]。本研究结果显示,两组患者的IL-8、IL-13、IL-17、hs-CRP、TNF-α、EOS均显著降低,IL-10显著升高,同时观察组上述指标的改善情况明显优于对照组。提示噻托溴铵联合沙美特罗/氟替卡松能有效缓解ACOS患者机体炎性,促进疾病良好转归。
肺功能是ACOS诊断的金标准,主要用于临床判断ACOS严重程度和评估治疗效果。因伴有哮喘可逆气流受限和小气道不完全可逆气流受限,ACOS患者大、小气道功能均发生明显降低[17]。本研究结果显示,联合治疗后,观察组患者肺功能指标均明显优于对照组,且治疗后观察组患者的CAT评分较对照组明显降低,ACT评分明显升高。提示联合治疗可明显改善ACOS患者的肺功能,减轻患者的临床症状。
综上所述,噻托溴铵联合沙美特罗/氟替卡松治疗能明显改善ACOS患者的炎症反应和肺功能,缓解患者临床症状,疗效显著可作为ACOS治疗的方案之一。
参考文献
[1]Bhatt S P.Increased Costs of the Asthma-Chronic Obstructive Pulmonary Disease Overlap Syndrome.One Syndrome for the Price of Two?[J].Annals of the American Thoracic Society,2016,13(2):158.
[2]García Hernández M J,López M G,Ruiz C E.How can we identify patients with asthma-copd overlap syndrome in clinical practice?[J].Archivos De Bron coneumologia,2015,52(2):59-60.
[3]Kurashima K,Takaku Y,Ohta C,et al.COPD assessment test and severity of airflow limitation in patients with asthma,COPD,and asthma-COPD overlap syndrome[J].International Journal of Chronic Obstructive Pulmonary Disease,2016,11(Issue 1):479.
[4]Maselli DJ,Peters JI.ACP Journal Club.Review:In COPD,tiotropium improves lung function and reduces adverse events compared with ipratropium bromide[J].Annals of internal medicine,2016,164(2):JC6.
[5]中华医学会呼吸病学分会慢性阻塞性肺疾病学组.慢性阻塞性肺疾病诊治指南[J].中华结核和呼吸杂志,2002,25(8):453-460.
[6]李凤云,霍建民.哮喘-慢性阻塞性肺疾病重叠综合征的诊疗进展[J].临床肺科杂志,2017,22(8):1508-1511.
[7]吕小东.[指南]支气管哮喘防治指南(2016年版)[J].中华结核和呼吸杂志,2017.
[8]Bujarski S,Parulekar A D,Sharafkhaneh A,et al.The asthma COPD overlap syndrome(ACOS)[J].Current Allergy&Asthma Reports,2015,15(3):509.
[9]Postma DS,van den Berge M.The different faces of the asthma-COPD overlap syndrome[J].The European respiratory journal,2015,46(3):587.
[10]Matsuse H,Yamagishi T,Kodaka N,et al.Tiotropium bromide as add-on therapy to inhaled corticosteroids for treating asthma[J].Expert Opinion on Pharmacotherapy,2015,16(9):1403-9.
[11]秦碧媛,曾春芳,王笑,等.异丙托溴铵治疗慢性阻塞性肺疾病—哮喘重叠综合征患者临床效果及对痰液细胞因子的影响[J].疑难病杂志,2017,16(9):885-888.
[12]Dhar R,Salvi S,Rajan S,et al.Salmeterol/fluticasone through breath-actuated inhaler versus pMDI:a randomized,double-blind,12 weeks study[J].Journal of Asthma Research,2015,52(10):1065-1072.
[13]Mehta N,Aggarwal B,Gogtay J,et al.Comparing the efficacy and safety of salmeterol/fluticasone pMDI versus its mono-components,other LABA/ICS pMDIs and salmeterol/fluticasone Diskus in patients with asthma[J].Expert Opin Drug Deliv,2015,12(6):1-13.
[14]Soulele K,Macheras P,Silvestro L,et al.Population pharmacokinetics of fluticasone propionate/salmeterol using two different dry powder inhalers[J].European Journal of Pharmaceutical Sciences Official Journal of the European Federation for Pharmaceutical Sciences,2015,80(2):33.
[15]Chin Kook Rhee.Phenotype of asthma-chronic obstructive pulmonary disease overlap syndrome[J].2015,30(4):443-449.
[16]刘媛媛,克丽别娜·吐尔逊,迪丽努尔,等.类固醇激素联合β2受体激动剂对哮喘-慢性阻塞性肺疾病重叠综合征的短期疗效[J].实用医学杂志,2017,33(15):2439-2442.
[17]Asai K,Watanabe T,Tochino Y,et al.Improvement of Awareness and Diagnosis for Chronic Obstructive Pulmonary Disease(COPD)by General Physician.Topics:III.Pathogenesis and Treatment of COPD;2.Asthma-
-COPD overlap syndrome(ACOS)[J].Nihon Naika Gakkai Zasshi the Journal of the Japanese Society of Internal Medicine,2015,104(6):1082.
关注SCI论文创作发表,寻求SCI论文修改润色、SCI论文代发表等服务支撑,请锁定SCI论文网! 文章出自SCI论文网转载请注明出处:https://www.lunwensci.com/yixuelunwen/19012.html