SCI论文(www.lunwensci.com):
摘要:目的探讨焦磷酸测序技术对MUTYH、PIK3C2B、ALDH1L1、TLR1、MAML3、PLG、COMP、AGT基因的12个位点的基因多态性与儿童紫癜性肾炎的相关性。方法由49例HSPN患儿及21例健康儿童组成,通过外周静脉血提取DNA,经PCR扩增后,通过焦磷酸测序法(Pyrosequencing法)对MUTYH、PIK3C2B、ALDH1L1、TLR1、MAML3、PLG、COMP、AGT基因进行单核苷酸多态性检测。结果HSPN患儿与健康儿童在AGT基因rs699位点CC基因型具有统计学意义(2=4.36,P=0.037,P<0.05)。结论AGT基因rs699位点CC基因型可能是儿童HSPN的发病重要影响因素。
关键词:儿童紫癜性肾炎;血管紧张素原基因多态性;单核苷酸多态性
本文引用格式:孟德雪,张君.儿童紫癜性肾炎血管紧张素原基因多态性分析[J].世界最新医学信息文摘,2019,19(61):3-4,6.
Analysis of Angiotensinogen Gene Polymorphism in Children with Henoch-Schonlein Purpura Nephritis
MENG De-xue1 ZHANG Jun2*
(1.Liaoning University of Traditional Chinese Medicine,Shenyang Liaoning;2.Affiliated Hospital of Liaoning University of Traditional Chinese Medicine,Shenyang Liaoning)
ABSTRACT:Objective To investigate the relationship between gene polymorphisms of MUTYH,PIK3C2B,ALDH1L1,TLR1,MAML3,PLG,COMP and AGT genes in children with purpuric nephritis by pyrosequencing.Methods 49 children with HSPN and 21 healthy children were enrolled.DNA was extracted from peripheral venous blood.After PCR amplification,MYTYH,PIK3C2B,ALDH1L1,TLR1,MAML3,PLG,COMP were processed by pyrosequencing(Pyrosequencing).The AGT gene was tested for single nucleotide polymorphism.Results The HS genotype of rs699 in AGT gene was statistically significant in children with HSPN and healthy children(2=4.36,P=0.037,P<0.05).Conclusion The CC genotype of rs699 at AGT gene may be an important factor in the pathogenesis of HSPN in children.
KEY WORDS:Children with purpuric nephritis;Angiotensinogen gene polymorphism;Single nucleotide polymorphism
0引言
紫癜性肾炎是肾小球系膜区IgA1-IgG沉积系膜细胞增生伴或不伴新月体形成的继发性肾脏疾病[1],是儿童最常见的继发性肾小球肾炎。其发病率占儿童继发性肾小肾炎的78.9%[2]。过敏性紫癜造成的肾脏病变多为镜下血尿,蛋白尿,严重者可见肉眼血尿,其发病率为20%-80%[3]。
有研究表明[4]机体在发病期存在严重的体液免疫系统紊乱、T淋巴细胞亚群功能失调以及细胞因子分泌异常等情况,免疫信号通路的异常与紫癜性肾炎的发生密切相关。因目前关于其具体发病原因尚不清楚。因此在本次研究中通过对文献的查找,我们选取了与可能造成B细胞发育和/或功能异常相关的COMP基因[5],参与造血及淋巴细胞发育的MAML基因之一的MAML3基因[6],在先天性免疫中起着重要作用的TLR1基因[7],与凝血、抗凝血、纤溶系统相关的PLG基因[8]与肾纤维化程度呈正相关的MUTYH基因[9]与肿瘤因子相关的PIK3C2B基因[10]、ALDH1L1基因[11]。
本研究选取了位于MUTYH、PIK3C2B、ALDH1L1、TLR1、MAML3、PLG、COMP、AGT基因的12个位点进行单核苷酸多态性检测,填补了儿童HSPN在基因研究领域的部分空白。
1资料和方法
1.1样本来源
病例组49例患儿均来源于近年在辽宁中医药大学附属医院门诊就诊患儿,男27人,女22人;平均(9.55±2.89)岁。健康儿童,男14人,女7人;平均(9.19±2.56)岁;HSPN的诊断依据儿童常见肾脏疾病诊治循证指南(二),紫癜性肾炎的诊治循证指南(试行)[12]。
1.2试剂与仪器
1.2.1试剂
DNA提取试剂盒:柱式血液基因组DNA抽提试剂盒(生工生物工程(上海)股份有限公司),PCR:SanPrep柱式PCR产物纯化试剂盒,(生工生物工程(上海)股份有限公司),测序BigDye Terminator v1.1、POP-7™Polymer、HiDi Formamide,ThermoFisher(Applied Biosystems™)。
1.2.2仪器
PCR仪、测序仪(美国ABI),凝胶成像仪(上海复日科技有限公司),电泳仪(北京六一仪器厂),冰箱(青岛海尔股份有限公司)。
1.3方法
1.3.1DNA提取
患儿禁食12h后于清晨空腹抽取外周静脉血2mL,收集于EDTA采血管中,于5分钟内分装同时置于-80℃冰箱内冷冻保存,用于提取DNA。
1.3.2由生工生物工程(上海)股份有限公司应用引物设计软件Premier 5软件对rs35352891、rs17847749、rs140551047、rs778022672、rs200212492、rs534986978、rs570805279、rs4252128、rs747448179、rs4762、rs699、rs566112479位点完成引物设计。
1.3.3PCR反应体系
每个扩增反应体系为50L,10×Taq Buffer(with MgCl2)5L,dNTP(10 mM)2L,上下游引物各2L,Taq酶0.5L,ddH2O,50L,模板DNA 1~2L。反应条件:95℃(5 min),35×(94℃30 sec,55℃25 sec,72℃50 sec),72℃5min。
1.3.4测序
1.3.4.1PCR产物纯化及条带切胶回收
①准备工作,检查Wash Solution中是否已加入乙醇;检查Buffer B3中是否已加入异丙醇;检查Buffer B3是否出现沉淀。
②在PCR反应液中加入5倍体积的Buffer B3,充分混匀。③8000xg离心30秒。倒掉收集管中液体。④加入500L Wash Solution.9000xg离心30秒,倒掉收集管中液体。⑤重复步骤4一次。⑥空柱于9000xg离心1分钟。将吸附柱放入一个干净的1.5mL离心管中,在吸附膜中央加入15~40L Elution Buffer,室温静置1分钟后,离心1分钟,保存管中DNA溶液。
1.3.4.2PCR产物的测序PCR反应,标准反应体系为20μL,纯化的PCR产物1μL,BigDye 4μL,BigDye Seq Buffer 2μL,测序引物1μL,灭菌去离子水12μL。反应条件:96℃(1 min),25×(96℃10 sec,50℃5 sec,60℃4 min)4℃。
1.3.4.3测序产物纯化
(1)每96孔依次加入2L 125mM EDTA和2L 3M NaAc到溶液中,再加入50L 100%酒精,盖好,震荡4次,室温15min。
(2)板式离心机3000xg 4℃离心30min;马上倒置96孔板,离心至185xg立即关闭离心机电源,停止离心。
(3)加70L 70%酒精,3000xg 4℃离心15 min;马上倒置96孔板,离心至185xg关闭离心机电源。此步可以重复1次。
(4)让酒精在室温挥发干净,加入10L Hi-Di Formamide溶解DNA。
(5)在PCR仪上变性:95℃4 min,4℃4min由生工生物工程(上海)股份有限公司采用sequence analysis软件对测序结果进行基因型分析。
1.4统计学分析
应用SPSS 23.0 for windows软件对年龄、性别等一般特征资料进行数据分析,所有符合正态分布或近似正态分布计量资料采用(±s)表示,两组间采用t检验。采用拟合优度卡方检验进行HWE平衡分析,以非条件逻辑回归分析所得的比值比(Odds ratios,OR)及其95%的置信区间(Confidence interval,95%CI)表示。基因型及其等位基因频率,各组间采用2检验,以P<0.05有统计学意义。
2结果
2.1通过对HSPN患儿与健康儿童比较,发现ALDH1L1基因rs778022672位点、MAML3基因rs570805279位点、COMP基因rs566112479位点无突变;
2.2通过对HSPN患儿与健康儿童进行分析,发现以下基因位点存在低频突变,但无统计学意义:
MUTYH基因rs35352891位点(P=0.736,P>0.05)、PIK3C2B基因rs17847749位点(P=1.000)、ALDH1L1基因rs140551047位点(P=1.000)、TLR1基因rs200212492位点(P=1.000)、MAML3基因 rs534986978 位点(P=0.549,P>0.05)、PLG 基因 rs4252128、rs747448179 位 点(P=1.000)、AGT 基 因 rs4762 位 点(P=0.728,P>0.05)。
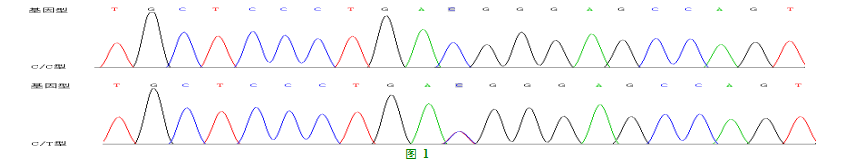
2.3AGT基因rs699位点基因型结果见图1。
2.4AGT基因rs699位点统计结果
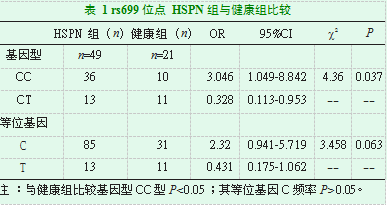
在49例HSPN患儿和21例健康组中,rs699位点基因CC型P=0.037,OR=3.046,95%CI=1.049-8.842,P<0.05,具有统计学意义。等位基因C频率,P=0.063,P>0.05,无统计学意义,结果见表1。
3讨论
儿童紫癜性肾炎是一种多基因、发病因素复杂的儿童肾系疾病之一,其占儿童继发性肾小球疾病的78.9%。少数患者可出现严重的肾脏病理损害,1%至7%[13]的患儿发展为终末期肾病。目前无论是从肾组织穿刺、代谢组学、基因多态性等方面的研究均是为了明确其发病机制,同时探寻其有效的治疗方式,而通过对其进行遗传学研究可以寻找到更加灵敏的标志物及为患儿提供更加准确的靶向治疗。肾素-血管紧张素系统在控制血压和钠稳态方面具有强大的作用。这些行动通过肾脏,心血管系统和中枢神经系统的综合行动进行协调。除此之外,肾素-血管紧张素系统还影响从炎症到免疫反应等一系列的发病过程。其中肾素-血管紧张素系统(RAS)的激活在慢性肾病的发病机制中起关键作用[14]。越来越多的证据表明,各种组织中的局部RAS,包括脑[15],心脏[16],脉管系统[17]和肾脏[18],均由系统性RAS独立调节。
血管紧张素II(Ang II)是RAS中最强大的生物活性产物,肾脏Ang II水平的异常升高可导致肾功能损害和肾组织损伤[14]。在肾脏中,Ang II来源于其局部形成的基质血管紧张素原[19](AGT)。实验研究已经表明,在肾组织AGT水平反映肾内RAS活性[14]。揭示了患者尿液中AGT水平的增加提示了慢性肾病的进展加重。因此,AGT在肾脏疾病的发展和进展中起重要作用。
国内外对于RAS基因多态性与HSP、HSPN的相关性研究表明,AGT基因多态性可以影响HSPN的发病[19]。本文就AGT基因rs699位点基因多态性与HSPN发病进行研究,即讨论HSPN患儿基因组中是否存在单个碱基上的变异,也就是单核苷酸多态性。
基因多态性又称遗传多态性,是精准医学分支之一,在一个生物群体中,会同时存在两种或多种不连续的基因型。主要包括DNA片段长度多态性、DNA重复序列多态性、单核苷酸多态性。本文研究的即是单核苷酸多态性,SNPs一般是有两种碱基构成,是一种二态的标记,有利于对其进行基因分型,可以对已知位点进行测序检测,或对未知位点进行筛查,其优势是可以快速、规模化筛查,对于临床应用更加具有优势。
因此笔者基于文献及NBCI的查找,基于前人对rs699位点的研究及目前尚未研究的位点进行了新一代测序,采用焦磷酸测序法 [20(]Pyrosequencing 法)。焦磷酸测序法是一种 DNA 测序方法,是一种理想遗传分析技术平台。是Sanger测序法的重要补充,与被普遍应用的限制性片段长度多态性聚合酶链反应(PCR-RFLP)技术相比具有灵敏度高、准确性高、精确性好等特点。同时焦磷酸测序极大的减少了认为影响因素,利于构建标准化的操作流程,做到最大的质量控制。
其中rs699是外显子2中的T至C取代,在密码子235(M235T)处产生功能性甲硫氨酸(M)至苏氨酸(T)交换,在高加索及亚洲成年人IgA肾病[21]过敏性紫癜、紫癜性肾炎[22]均具有相关性研究。本次研究的结果也显示HSPN病例组与健康对照组的分布具有明显的差异性。与正常儿童相比差异有统计学意义(P=0.037)纯合子CC型及其C等位基因频率显著高于正常儿童。
我们认为AGT基因rs699位点在HSPN发病、病情进展及判断预后方面可能起到一定作用。纯合子CC型的携带可能是该病的一种重要的危险因素,总的来说我们的结果可以部分地表明其是HSPN遗传因素之一。
参考文献
[1]Yamakawa T,Yamamoto I,Komatsuzaki Y,et al.Successful treatment of recurrent Henoch-Schönlein purpura nephritis in a renal allograft with allograft with tonsillectomy and steroid pulse therapy[J].Nephrology(Carlton),2016,21:53-56.
[2]Ling LG,Fu GY,Kun XZ,et al.The pathological analysis of 2551 children patients with glomerulopathy[in Chinese][J].J Med Postgra,2011,24:294-7.
[3]Mao Y,Yin L,Huang H,et al.Henoch-Schönlein purpura in 535 Chinese children:clinical features and risk factors for renal involvement[J].J Int Med Res,2014,42:1043-9.
[4]Qing Ye,Shi-qiang Shang,Ai-min Liu,et al.24h Urinary Protein Levels and Urine Protein/Creatinine Ratios Could Probably Forecast the Pathological Classificationg of HSPN[J].PLoS One,2015,10(5):eo127767.
[5]葛青,李萍萍,徐希.软骨寡聚基质蛋白(COMP)对B淋巴细胞发育及功能的影响.第八届全国免疫学学术大会[C].265-266.
[6]Lizi Wu,Ivan Maillard,Makoto Nakamura,et al.The transcriptional coactivator MamL1 is required for Notch2-mediated marginal zone B-cell development[J].Blood,2007,15;110(10):3618-3623.
[7]肖林,肖文娟,刘泽寰,等.广东地区汉族人群TLR1基因多态性的测序研究[J].中国病理生理杂志,2011,27(11):2140-2146.
[8]Qianyi Ma,Ayse B.Ozel,Shweta Ramdas,et al.Genetic variants in PLG,LPA,and SIGLEC 14 as well as smoking contribute to plasma plasminogen levels[J].Blood,2014,124(20):3155-3164.
[9]Jianping Lu,Xinxiu Li,Mingcao Zhang,et al.Regulation of MUTYH,a DNA Repair Enzyme,in Renal Proximal Tubular Epithelial Cells[J].Oxid Med Cell Longev,2015,2015:682861.
[10]Marcus Kind,Jolanta Klukowska-Rötzler,Sabina Berezowska,et al.Questioning the role of selected somatic PIK3C2B mutations in squamous non-small cell lung cancer oncogenesis[J].PLoS One,2017,12(10):e0187308.
[11]Guangzhi Zhu,Xiwen Liao,Chuangye Han,et al.ALDH1L1 variant rs2276724 and mRNA expression predict post-operative clinical outcomes and are associated with TP53 expression in HBV-related hepatocellular carcinoma[J].Oncol Rep,2017,38(3):1451-1463.
[12]中医药学会儿科学分会肾脏病学组.儿童常见肾病诊治指南(二):紫癜性肾炎的证治循证指南(试行)[J].中华儿科杂志,2009,47(12):911-913.
[13]Spasojevic-Dimitrijeva B,Kostic M,Peco-Antic A,et al.Henoch-Schönlein purpura outcome in children:a ten-year clinical study[J].Srp Arh Celok Lek,2011,139:174-8.
[14]Narchi H.Risk of long term renal impairment and duration of follow up recommended for Henoch-Schönlein purpura with normal or minimal urinary findings:a systematic review[J].Arch Dis Child,2005,90:916-20.
[15]Baltatu O,Silva JA,Jr,Ganten D,et al.The brain renin-angiotensin system modulates angiotensin II-induced hypertension and cardiac hypertrophy[J].Hypertension,2000,35:409-412.
[16]Dell'Italia LJ,Meng QC,Balcells E,et al.Compartmentalization of angiotensin II generation in the dog heart.Evidence for independent mechanisms in intravascular and interstitial spaces[J].J Clin Invest,1997,100:253-258.
[17]Danser AH,Admiraal PJ,Derkx FH,et al.Angiotensin I-to-II conversion in the human renal vascular bed[J].J Hypertens,1998,16:2051-2056.
[18]Navar LG,Harrison-Bernard LM,Nishiyama A,et al.Regulation of intrarenal angiotensin II in hypertension[J].Hypertension,2002,39:316-322.
[19]吴春蕾,樊忠民,夏正坤,等.血管紧张素原基因多态性与儿童过敏性紫癜及紫癜性肾炎的关系[J].临床儿科杂志,2009,27(4):314-316.
[20]李靖轩,金益如,徐吟秋,等.基于焦磷酸测序技术的基因突变检测在精准医疗中的应用研究进展变[J].药学进展,2015,39(12):889-895.
[21]Song Mao,songming huang.Association of angiotensinogen gene M235T polymorphism with the risk of IgA nephropathy:a meta-analysis[J].Renal Failure,2014,36(3):466-472.
[22]Song Mao,songming huang.Association of AGT M235T gene polymorphism with HSP/HSPN risk[J].Renal Failure,2015,37(1):16-21.
关注SCI论文创作发表,寻求SCI论文修改润色、SCI论文代发表等服务支撑,请锁定SCI论文网! 文章出自SCI论文网转载请注明出处:https://www.lunwensci.com/yixuelunwen/17843.html