SCI论文(www.lunwensci.com):
摘要:目的探究乳腺原位癌伴微浸润癌在术中冰冻中的临床病理特点。方法回顾性分析我院2014年6月至2018年12月收治的2400例单侧乳房肿块就诊病例,依据术后足量取材常规石蜡病理结果分为导管原位癌(DCIS组)49例,乳腺原位癌伴微浸润性癌(DCIS-MBC组)49例,对两组患者在术中冰冻中的临床病理特点进行分析和比较。结果两组患者在分子分型、组织学分级、Ki67情况、HER-2情况、ER阳性率及PR阳性率比较差异明显(P<0.05),其中DCIS-MBC组HER-2过表达者,HER-2、Ki67高表达者比例,ER及PR阴性率比例显著比DCIS组高(P<0.05)。结论HER-2过表达、HER-2、Ki67高表达、ER、PR阴性率、高级别组织学分级是乳腺原位癌伴微浸润的重要临床病理特点。因导管原位癌伴微浸润的主要原因会使治疗方案及预后存在较大差异,因此术中快速冰冻中区分导管原位癌是否伴微浸润是临床及病理医师共同关注的重点。
关键词:乳腺原位癌;微浸润;术中冰冻;病理特点
本文引用格式:冯小莉.乳腺原位癌伴微浸润在术中冰冻中的临床病理特点[J].世界最新医学信息文摘,2019,19(54):35-36.
0引言
在临床女性恶性肿瘤中,乳腺癌较为常见,30~59岁女性是该种疾病的多发群体,并且其发病率及致死率不断升高,对患者生命健康和生活品质造成了严重威胁,因而开展乳腺癌普查意义重大[1]。近年来在乳腺癌的普查当中,彩超及乳腺钼靶应用较为广泛,随着检查技术水平的不断提升,乳腺导管原位癌(DCIS)及导管原位癌伴微浸润性癌(DCIS-MBC)的检出率也得到了提高[2]。乳腺导管原位癌是以终末导管小叶单位内的导管肿瘤细胞在基底膜内异常增殖为主要特点,而DCIS-MBC则是导管原位癌突破基底膜而形成的,并以癌灶的大小和数量推荐了多个量化标准。但根据2009年美国癌症联合委员会(AJCC)乳腺癌分期仍沿用乳腺癌细胞突破基底膜进入临近间质,最大径不超过1mm。在DCIS中DCIS-MBC占比最高可达20%[3]。本文主要分析了乳腺原位癌伴微浸润在术中冰冻中的临床病理特点,报告如下。
1资料与方法
1.1一般资料
回顾性分析我院2014年6月至2018年12月收治的2400例单侧乳房肿块就诊病例,依据术后常规石蜡病理结果分为导管原位癌(DCIS组)49例,乳腺原位癌伴微浸润(DCIS-MBC组)49例。本次研究的所有患者皆为女性,DCIS-MBC组年龄26~76岁,平均(51.24±3.47)岁。
1.2方法
患者乳腺肿块的病理检查采用术中快速冰冻切片病理诊断方法进行,术后再行肿块常规石蜡切片病理诊断方法,以确定诊断结果的准确性进行保证。石蜡常规免疫组化ER,PR,C-erbB-2,P63,calponin,Ki67,E-cadherin,P120。乳腺癌组织中的Ki67、孕激素受体(PR)、雌激素受体(ER)、人类表皮生长因子受体2(HER-2)等表达情况采用常规免疫组化链霉菌抗生物素蛋白-过氧化物酶连结法检测。免疫组化试剂主要采自中杉金桥生物技术有限公司生产的PH8.0~9.0修复液,相关操作依据说明书进行。确诊后,依据患者病情状况,选取有效的方式治疗,避免错误的治疗方式。
1.3观察指标
对两组患者在术中冰冻中的临床病理特点进行分析和比较。包括浸润癌灶、组织学分级、肿块最大直径、分子分型、Ki67、孕激素受体(PR)、雌激素受体(ER)、人类表皮生长因子受体2(HER-2)等。
1.4统计学方法
研究数据均在SPSS21.0中纳入并进行分析和统计,计数资料行卡方检验,计量资料行t检验,检验标准P<0.05。
2结果
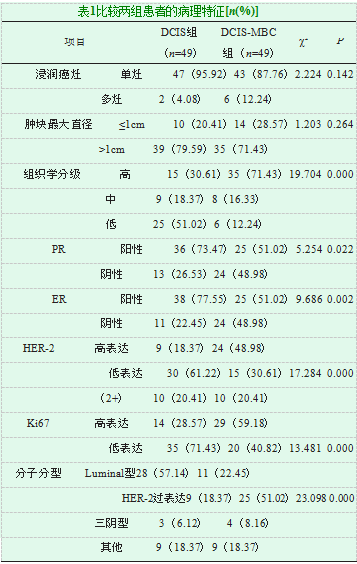
两组患者在分子分型、组织学分级、Ki67情况、HER-2情况、PR阳性率及ER阳性率比较差异明显(P<0.0.5),其中DCIS-MBC组HER-2过表达者,HER-2、Ki67高表达者比例,ER及PR阴性率比例显著比DCIS组高(P<0.05),见表1。
3讨论
近年来,导管原位癌(D C I S)及乳腺原位癌伴微浸润(D C I S-M B C)的发病检出率不断提升,乳腺癌中的这两种类型对患者身体和心理健康具有一定的危害性,因导管原位癌和微浸润性癌的临床治疗方法存在差异,导管原位癌是否同时存在浸润是临床和病理医师共同关注的焦点问题,对于病理医师具有一定的困难,尽早诊断十分关键,可为临床医师治疗方案的制定提供可靠的参考依据。在以往的研究当中,认为DCIS-MBC仅仅是DCIS过渡到浸润性导管癌的一个阶段[4],但是在近几年的临床研究中得出,DCIS-MBC与DCIS存在较大的差异,因其潜在的转移能力和侵袭能力,它可作为实体肿瘤的一种类型[5],因此对DCIS-MBC临床病理特征进行分析意义重大。
在临床上DCIS所表现出的临床症状并不具有特异性,近年来乳腺钼靶的应用,使得检出率得到极大提升,同时DCIS-MBC的检出率也得到明显提升。长时间以来,乳腺微浸润癌的诊断标准并不统一,直到2012年,WHO采用了AJCC标准,使乳腺微浸润癌的诊断标准得以推行。在临床病理诊断上DCIS-MBC主要指的是基底膜被导管原位癌癌细胞突破,浸润灶最大直径不高于1mm[6]。DCIS-MBC存在较大的转移风险,与单纯的导管原位癌存在较大的不同。因此对乳腺原位癌伴微浸润在术中冰冻中的临床病理特点进行分析十分重要,可提升对该种疾病的认知深度,便于对导致其发生的相关危险因素进行防控,进而使乳腺原位癌伴微浸润性癌发生率得以降低。
本研究对DCIS及DCIS-MBC的临床病理特征进行了分析,结果显示,两组患者在分子分型、组织学分级、Ki67情况、HER-2情况、PR阳性率及ER阳性率比较差异明显(P<0.0.5),其中DCIS-MBC组HER-2过表达者,
HER-2、Ki67高表达者比例,PR及ER阴性率比例显著比DCIS组高(P<0.05)。由此可得出,在分子分型中,Luminal型是DCIS的主要类型,HER-2过表达是DCIS-MBC主要类型,这与汪雯洁等[7]的研究一致。分析原因:这可能由于DCIS增生并不具有典型性,在过渡到浸润性导管癌这一过程中,HER-2过表达逐渐下降[8]。有临床研究显示,HER-2过表达同乳腺癌不良预后及其侵袭存在较大的相关性,由此可说明,DCIS-MBC患者预后状况理想程度可能不高。
综上所述,HER-2过表达,HER-2、Ki67高表达,PR、ER阴性率,高级别组织学分级是乳腺原位癌伴微浸润的重要临床病理特点,临床医师需加以明确,便于对乳腺原位癌伴微浸润发生的危险因素进行防范。
参考文献
[1]陈文静,张江宇,陈中扬,等.乳腺导管原位癌分子分型的临床研究[J].中华乳腺病杂志(电子版),2017,11(5):262-265.
[2]李爽,郎冠天,余科达,等.乳腺导管原位癌和乳腺导管原位癌伴微浸润的分子分型差异性研究[J].中国癌症杂志,2018,28(5):383-388.
[3]曾玉梅,曹晓珊,杜娟,等.乳腺浸润性筛状癌与筛状结构导管原位癌的临床病理及免疫组化对比分析[J].分子诊断与治疗杂志,2017,9(4):261-266.
[4]Kumar KS,Hemanth GN,Panjwani PK,et al.Feasibility of Axillary Reverse Mapping and Clinicopathological Features Predicting ARM Node Metastasis in Breast Cancer-a Pilot Study[J].Indian Journal of Surgical Oncology,2017,8(2):119-120.
[5]董燕燕,刘云霄.乳腺大汗腺型导管原位癌累及硬化性腺病的临床病理分析[J].中国实用医刊,2018,45(13):4-7.
[6]袁聪聪,陈曼.乳腺导管原位癌超声造影特征的临床研究[J].肿瘤影像学,2018,27(1):12-16.
[7]汪雯洁,丁小军,王敏,等.乳腺导管原位癌伴微浸润的临床病理特征及危险因素[J].广西医学,2017,39(10):1490-1493.
[8]Liu Z,Sun M,Xiao Y,et al.Predictors of metastasis to lymph nodes posterior to the right recurrent laryngeal nerve in differentiated thyroid carcinoma:Aprospective study[J].Asian Journal of Surgery,2017,40(4):270-277.
关注SCI论文创作发表,寻求SCI论文修改润色、SCI论文代发表等服务支撑,请锁定SCI论文网! 文章出自SCI论文网转载请注明出处:https://www.lunwensci.com/yixuelunwen/17180.html