SCI论文(www.lunwensci.com):
摘要:透明质酸(hyalronic acid HA)具有良好的机械强度、生物相容性和可塑性,可作为促进骨组织修复的生长因子的有效基质, 是一种理想的骨诱导材料。本文介绍了HA在诱导成骨方面的相关实验,并对未来的研究进行了展望。
关键词:透明质酸;成骨;组织工程
本文引用格式:郭倩楠 , 张丽萍 , 张丞 , 等 . 透明质酸在诱导成骨方面的研究进展 [J]. 世界最新医学信息文摘,2018,18(72):109-110,112.
Progress in the Study of Hyaluronic Acid in the Induction of Osteogenesis
GUO Qian-nan1, ZHANG Li-ping2, ZHANG Cheng1, LIU Peng2, LI Yi-jie2
(1.North China University of science and technology, Tangshan Hebei;
2.Affiliated Hospital of North China University of science and technology, Tangshan Hebei)
ABSTRACT: Hyaluronic acid has good mechanical strength, biocompatibility and plasticity, which can be used as an effective matrix to promote bone tissue repair, and is an ideal bone inducing material. This article introduces the related experiments of HA in inducing osteogenesis, and looks forward to the future research.
KEY WORDS: Hyalronic acid; Osteogenesis; Tissue engineering
引 言
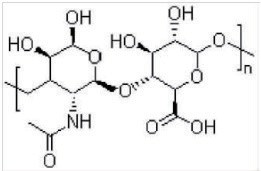
透明质酸(Hyaluronic acid,HA)是一种天然存在,可生物降解,并且用途广泛的大分子酸性黏多糖,它几乎是所有哺乳动物结缔组织细胞外基质(ECM)的天然组成成分,广泛存在于结缔组织、上皮和神经组织中 [1]. 也是大多数体液的重要成分,如关节液、透明软骨、结缔组织的滑液和眼睛的玻璃体等 [2]。透明质酸(HA)是一种线性的、非硫酸化的糖胺聚糖 [3],它是由 D- 葡萄糖醛酸和 N- 乙酰氨基葡萄糖的重复结构构成,分子式是:(C14H20NNaO11)n,结构式如下图:
HA 是一种阴离子,可以和水分子相结合,具有较强的吸水能力,有类似与明胶样坚硬、粘稠、润滑等物理特性 [4] 可以增强细胞迁移和增殖,同时其作为富含羧基的细胞外基质组分,还具有良好的生物相容性和低免疫原性 [5]。HA 独特的理化性质和生物学特性,可使其在医学多个领域应用,包括用于组织工程、辅助眼科手术和伤口再生 [6]。此外,近期有科学家进行了探索,研究表明其可通过不同的给药途径作用于鼻腔、口腔、肺、眼和胃肠等从而在局部发挥作用 [7]。H A医学应用研究之父 Balazs,将HA的应用分为5大方面,分别是黏弹性补充疗法(Viscosupplementation)、黏弹性填(Viscoaugmentation)、黏弹性手术(Viscosurgery)、黏弹性阻隔(Viscoseparation)、黏弹性防(Viscoprotection)[8]。HA有良好的生物相容性、良好的机械强度,并可逐步降解且易于加工制作,形成的材料-细胞界面易于细胞的粘附, 能保存细胞的分化能力。其在空间上具有三维多孔结构 [9], 提供的三维支架允许干细胞在空间上分布,模仿天然微环境, 并保持机械稳定 [10],细胞可利于植入的材料在短期内达到丰富的血管再生,使支架材料形成充足的分支结构。近年来, 有研究表明通过体外及动物实验研究发现HA能有效诱导成骨,HA 作为一种良好的骨诱导支架材料,成为当今研究热点。
本文将就透明质酸在诱导成骨方面的研究进展做一阐述。
1成骨机制
透明质酸(HA)作为细胞载体和用于组织工程的水凝胶,可作用于多种类型的细胞,包括软骨细胞和骨髓间充质干细胞(MSCs)[11],当软骨细胞或骨髓间充质干细胞在成软骨条件下进行 HA 水凝胶培养,这些水凝胶机结构的机械功能增加,ECM 含量也随着时间变化 [12]。
透明质酸可诱导产生成纤维细胞、角质形成细胞,促炎性细胞因子,促进成骨细胞和成骨细胞炎症反应并从而刺激血管内皮细胞合成 [13],进而促进骨间充质细胞再生、趋化、增殖与分化,并可作用于骨形态发生蛋白 -2 和骨桥蛋白从而诱导成骨 [14]。
透明质酸能在早期诱导碱性磷酸酶(ALP)分泌,上调骨钙素基因表达水平,且可与 DEX、rhBMP-2 相互作用影响细胞增殖与分化 [15]。HA 可以和 CD44 和 RHAMM 受体相互作用,可以通过 CD44 受体促进干细胞早期向软骨细胞的分化,并对功能性 ECM 沉积有积极影响 [16],同时可激活各种信号通路,指导广泛的细胞功能 [17] 和蛋白多糖、II 型胶原相互作用。长链 HA 作为聚集蛋白聚糖的骨干,可以促进功能性 ECM 的发展,同时能影响软骨细胞和 NP 细胞积极地产生ECM,促进细胞迁移,并且维持细胞的表型 [18]。研究者在胚胎发育过程中也发现了 HA,研究提示在脐带中由 HA 组成的物质可为组织再生提供有利条件 [19]。
2诱导成骨
2.1体外实验
有研究者在 HA 水凝胶中对软骨细胞和骨髓间充质干细胞进行培养,这些水凝胶构建的体系机械强度增加,ECM 含量也随时间变化 [20]。Peroglio 等人开发了透明质酸盐热可逆水凝胶(HA-pNIPAM)充当 NP 细胞载体,并培养细胞构建体 1 周,结果显示 HA-pNIPAM 水凝胶与藻酸盐凝胶相比, 其可以维持 NP 细胞表型并促进 ECM 形成 [28]。Collin 等人研制出的可注射 II 型胶原 -HA 水凝胶可促进细胞活力 [22]。
Park 等研制的纤维蛋白 -HA- 蚕丝复合凝胶,可促进 II 型胶原,Sox9 基因 (Sox9 是软骨细胞表型的主调节器,参与控制II 型胶原激活和合成 ) 和蛋白多糖表达增加 , 并保持机械完整性 [23]。
透明质酸(HA)固定在钛涂层表面可以改善其生物学性质,有实验将 HMSC 接种到该材料上,体外培养 12 小时,在扫描电镜下观察,所有的细胞都表现出对材料的良好依恋 , 与对照组相比,细胞板状伪足更紧密地附着在材料表面,有更好的细胞骨架及形态。表明在钛涂层表面引入 HA 改善了细胞与材料相互作用,TC-AAH 样品为 HMSC 提供更有利的表面,TC-AAH 上的 HMSC 显示出比对照组更好的细胞骨架形态 [5]。
也有研究发现,透明质酸传递的骨形态发生蛋白 -2, 与单纯的同等剂量的骨形态发生蛋白 -2 相比,其具有高爆
发、持续释放的特点,其诱导骨形成高达 465%[24],从而改善了骨形态发生蛋白 -2 在“超生理学”剂量才能诱导成骨的特点 [25],也减少了其在诱导成骨时所需的高剂量产生的一系列副作用,包括脊髓撞击致异位骨形成 [26]、破骨细胞活化伴瞬时升高的骨吸收 [27]、囊肿样骨质空洞形成和危及生命的宫颈癌,从而扩大了 BMP-2 的整体临床功效。
生长分化因子 -5(GDF-5)是肢体发育的重要因素,是BMP 家族的成员之一,研究证明,其可促进犬的牙槽骨和牙骨质的形成 [28]。然而在近期的研究中,我们发现,将 GDF-5 载入到光固化的 HA 凝胶中,其促进成骨作用更强,持续时间更久,实验证明 HA 水凝胶作为载体,可控制并有助于GDF-5 持续释放 [28]。
2.2体内实验
就伤口愈合机制和硬组织发育的相关性而言,HA 可以被认为细胞再生的“引物”。透明质酸作为一种重要的细胞外基质成分,在骨形态发生期间,大量的 HA 存在于间充质细胞向软骨细胞的过渡期。Sasaki & Watanabe 在大鼠股骨骨髓消融模型中证明,HA 能够加速间充质细胞分化形成新骨, 实验表明应用 HA 第 4 天后开始诱导新骨形成 [30]。
在透明质酸 - 胶原复合的支架材料可以改善骨骼临界骨缺损愈合这一研究中表明,在骨缺损区单独放置可吸收明胶海绵(ACS),经过两个月的饲养后,缺损区有薄薄的一层结缔组织覆盖和少量的新骨形成,实验组缺陷区放置 1% HA 凝胶浸泡过的可吸收明胶海绵,缺损区出现一层较厚的结缔组织,并观察到在缺陷边缘有更多的新骨形成 [30]。
在将透明质酸水凝胶作为 BMP-2 载体修复小型猪颅骨临界骨缺损这一实验中,将 1.25mgBMP-2 交联在透明质酸水凝胶中,其诱导成骨作用大于两个因素单独作用于缺损区的对照组,实验组的骨体积增加,大量致密骨的形成,骨缺损区完全愈合且水凝胶在 3 个月内被完全吸收,更重要的是没有引起炎症反应 [31]。
Ballini 等人发现用酯化的低分子 HA 结合自体骨,能加速新骨的形成能力,修复骨缺损 [32]。2009 年度列奥纳多,临床观察酯化的 HA 用于重度牙周病的疗效,在磨牙根分叉区放置 HA 纤维。治疗 1 年后,平均探诊深度(PPD)减少了 5.8毫米,增益为 2.8 毫米 [32]。
3不足与展望
HA 作为较理想的组织工程材料,已成为医疗行业临床应用和科研的热点。但是在骨缺损修复的应用中,HA 交联反应产生的一系列毒副作用成为HA 应用的限制因素。此外, 其应用于骨组织工程仍然仅局限于小范围缺损的修复。但是因为 HA 具有独特的理化性质和生物学特性,有理由相信, 随着科研的不断深入和引导骨再生技术的不断发展,它将为医学领域添上意义深远的一笔。
参考文献:
[1]Bae M S, Yang D H, Lee J B, et al. Photo-cured hyaluronic acid-based hydrogels containing simvastatin as a bone tissue regeneration scaffold[J]. Biomaterials, 2011, 32(32):8161-8171.
[2]Fakhari A, Berkland C. Applications and Emerging Trends of Hyaluronic Acid in Tissue Engineering, as a Dermal Filler, and in Osteoarthritis Treatment[J]. Acta Biomaterialia, 2013, 9(7):7081-7092.
[3]YIN X, LI P , LI Y,et al. Growth/differentiation factor5 promotes in vitro/vivo periodontal specific differentiation of induced pluripotent stem cellderived mesenchymal stem cells [J]. Experimental And Therapeutic Medicine,2017,14: 4111-4117.
[4]Necas J, Bartosikova L, Brauner P, Kolar J. Hyaluronic acid (hyaluronan): a review[J]. Vet Med, 2008,53:397-411.
[5]Ao H, Xie Y, Qin A, et al. Immobilization of hyaluronic acid on plasma- sprayed porous titanium coatings for improving biological properties[J]. Journal of Biomaterials Science Polymer Edition, 2014, 25(11):1211-1224.
[6]Falcone S, Palmeri D, Berg R. Biomedical applications of hyaluronic acid[J]. ACS Publications,2006:155-174.
[7]Hamidi M, Azadi A, Rafiei P. Hydrogel nanoparticles in drug delivery[J]. Adv Drug Deliv Rev,2008,60:1638-49.
[8]魏健 , 刘建建 , 黄思玲 , 等 . 透明质酸交联衍生物的研究进展 [J]. 高分子材料科学与工程 ,2017,33(10):183-190.
[9]肖芳 , 柳毅 , 徐高丽 , 等 . 透明质酸支架材料诱导成骨的研究进展 [J]. 口腔医学研究 ,2016,32(9):997-999.
[10]Bae M S, Ohe J Y, Lee J B, et al. Photo-cured hyaluronic acid-based hydrogels containing growth and differentiation factor 5 (GDF-5) for bone tissue regeneration[J]. Bone, 2014, 59(1):189-198.
[11]Kim I L, Mauck R L, Burdick J A. Hydrogel design for cartilage tissue engineering: A case study with hyaluronic acid [J]. Biomaterials, 2011, 32(34):8771-8782.
[12]Chung C, Burdick J A. Influence of three-dimensional hyaluronic acid microenvironments on mesenchymal stem cell chondrogenesis[J]. Tissue Engineering Part A, 2009, 15(2):243.
[13]Turley E A, Noble P W, Bourguignon L Y. Signaling properties of hyaluronan receptors[J]. Journal of Biological Chemistry, 2002, 277(7):4589.
[14]Ruggiero S L, Bertolami C N, Bronson R E, et al. Hyaluronidase activity of rabbit skin wound granulation tissue fibroblasts[J]. Journal of Dental Research, 1987, 66(7):1283-1287.
[15]Zou X, Li H, Chen L, et al. Stimulation of porcine bone marrow stromal cells by hyaluronan, dexamethasone and rhBMP-2[J]. Biomaterials, 2004, 25(23):5375-5385.
[16]Bian L, Guvendirena M, Mauck RL, Burdick JA. Hydrogels that mimic developmentally relevant matrix and N-cadherin interactions enhance MSC chondrogenesis[J]. PNAS, 2013,110(25):10117-10122.
[17]Ao H, Xie Y, Tan H, Wu X, Liu G, Qin A, Zheng X, Tang T. Improved hMSC functions on titanium coatings by type I collagen immobilization. J. Biomed. Mater[J]. Res. Part A,2014,102A:204-214.
[18]Kim D H, Martin J T, Elliott D M, et al. Phenotypic stability, matrix elaboration and functional maturation of nucleus pulposus cells encapsulated in photocrosslinkable hyaluronic acid hydrogels[J]. Acta Biomaterialia, 2015, 12(1):21-29.
[19]Eng D, Caplan M, Preul M, Panitch A. Hyaluronan scaffolds-a balance between backbone functionalization and bioactivity[J]. Acta Biomater,2010,6:2407-2414.
[20]Erickson IE, Kestle SR, Zellars KH, Farrell MJ, Kim M, Burdick JA, et al. High mesenchymal stem cell seeding densities in hyaluronic acid hydrogels produce engineered cartilage with native tissue properties[J]. Acta Biomater,2012,8:3027-3034.
[21]Peroglio M, Grad S, Mortisen D, Sprecher CM, Illien-Jünger S, Alini M, et al. Injectable thermoreversible hyaluronan-based hydrogels for nucleus pulposus cell encapsulation[J]. Eur Spine J, 2012,21(6):S839-849.
[22]Collin EC, Grad S, Zeugolis DI, Vinatier CS, Clouet JR, Guicheux JJ, et al. An injectable vehicle for nucleus pulposus cell-based therapy[J]. Biomateria ls,2011,32(11):2862-2870.
Park SH, Cho H, Gil ES, Mandal BB, Min BH, Kaplan DL. Silk-fibrin/hyaluronic acid composite gels for nucleus pulposus tissue regeneration[J]. Tissue Eng Part A,2011,17(23):2999-3009.
[24]Bhakta G, Lim Z X, Rai B, et al. The influence of collagen and hyaluronan matrices on the delivery and bioactivity of bone morphogenetic protein-2 and ectopic bone formation[J]. Acta Biomaterialia,2013,9(11):9098-9106.
[25]McKay WF, Peckham SM, Badura JM. A comprehensive clinical review of recombinant human bone morphogenetic protein-2 (INFUSE Bone Graft) [J]. Int Orthop,2007,31:729-734.
[26]Wong DA, Kumar A, Jatana S, Ghiselli G, Wong K. Neurologic impairment from ectopic bone in the lumbar canal: a potential complication of off- label PLIF/ TLIF use of bone morphogenetic protein-2 (BMP-2) [J]. Spine J,2008,8:1011-1018.
[27]Kaneko H, Arakawa T, Mano H, et al. Direct stimulation of osteoclastic bone resorption by bone morphogenetic protein (BMP)-2 and expression of BMP receptors in mature osteoclasts[J]. Bone,2000,27(4):479-486.
[28]Gruber RM, Ludwig A, Merten HA, Pippig S, Kramer FJ, Schliephake
H. Sinus floor augmentation with recombinant human growth and differentiation factor-5 (rhGDF-5): a pilot study in the Goettingen miniature pig comparing autogenous bone and rhGDF-5[J]. Clin Oral Implants Res,2009,20(2):175-182.
[29]Bae M S, Ohe J Y, Lee J B, et al. Photo-cured hyaluronic acid-based hydrogels containing growth and differentiation factor 5 (GDF-5) for bone tissue regeneration[J]. Bone,2014,59(1):189-198.
[30]De B B B, Mendes Brazão M A, de Campos M L, et al. Association of hyaluronic acid with a collagen scaffold may improve bone healing in critical- size bone defects[J]. Clinical Oral Implants Research,2012,23(8):938-942.
[31]Dochertyskogh A C, Bergman K, Waern M J, et al. Bone morphogenetic protein-2 delivered by hyaluronan-based hydrogel induces massive bone formation and healing of cranial defects in minipigs[J]. Plastic & Reconstructive Surgery,2010,125(5):1383.
[32]De A N M, Cintra N, Maló P. Peri-implant maintenance of immediate function implants: a pilot study comparing hyaluronic acid and chlorhexidine[J]. International Journal of Dental Hygiene,2007,5(2):87-94.
[33]Ballini A, Cantore S, Capodiferro S, et al. Esterified Hyaluronic Acid and Autologous Bone in the Surgical Correction of the Infra-Bone Defects[J]. International Journal of Medical Sciences,2009,6(2):65-71.
《透明质酸在诱导成骨方面的研究进展论文》附论文PDF版下载:
http://www.lunwensci.com/uploadfile/2018/1031/20181031053828638.pdf
关注SCI论文创作发表,寻求SCI论文修改润色、SCI论文代发表等服务支撑,请锁定SCI论文网!
文章出自SCI论文网转载请注明出处:https://www.lunwensci.com/yixuelunwen/1401.html